
【题目】化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
(1)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色,则该溶液呈性,原因是;(用离子方程式表示)
(2)在常温下将pH=2的盐酸10mL加水稀释到1L,则稀释后的溶液的pH值等于;
(3)已知在H2S溶液中存在下列平衡:H2S═HS﹣+H+①向H2S溶液中加入NaOH固体时,(不考虑温度变化)电离平衡向移动,(填“左”或“右”)c(H+) . (填“增大”、“减小”或“不变”)
②向H2S溶液中加入NaHS固体时,电离平衡向移动,(填“左”或“右”)c(S2﹣) . (填“增大”、“减小”或“不变”)
(4)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.则图中表示醋酸溶液中pH变化曲线的是(填“A”或“B”);设盐酸中加入的Zn质量为m1 , 醋酸溶液中加入的Zn质量为m2 . 则m1m2 . (选填“<”、“=”、“>”) 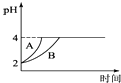
(5)难溶电解质在水溶液中存在溶解平衡.某MgSO4溶液里c(Mg2+)=0.002molL﹣1 , 如果生成Mg(OH)2沉淀,应调整溶液pH,使之大于;(该温度下Mg(OH)2的Ksp=2×10﹣11)
【答案】
(1)碱性;CO32﹣+H2O?HCO3﹣+OH﹣
(2)4
(3)右;减小;左;增大
(4)B;<
(5)10
【解析】解:(1)碳酸钠为强碱弱酸盐,钠离子不水解、碳酸根离子水解导致溶液呈碱性,水解离子方程式为:CO32﹣+H2OHCO3﹣+OH﹣,
故答案为:碱性;CO32﹣+H2OHCO3﹣+OH﹣; (2)pH=2的盐酸,稀释100倍后溶液的pH变为4,故答案为:4; (3)①向H2S溶液中加入NaOH固体时,氢离子的浓度减小,电离平衡向右移动,故答案为:右;减小;②向H2S溶液中加入NaHS固体时,硫氢根离子浓度变大,H2S═HS﹣+H+电离平衡向左移动,硫氢根离子的电离,c(S2﹣)增大,故答案为:左;增大;(4)由于醋酸是弱电解质,与Zn反应同时,电离出H+,所以pH变化较缓慢,所以B曲线是醋酸溶液的pH变化曲线.由图知盐酸和醋酸的pH变化都是由2到4,盐酸中氢离子浓度逐渐减小,但醋酸中存在电离平衡,氢离子和锌反应时促进醋酸电离,补充反应的氢离子,所以醋酸是边反应边电离H+,故消耗的Zn多,所以m1<m2.
故答案为:B;<;(5)0.002molL﹣1MgSO4溶液中c(Mg2+)=0.002mol/L,沉淀平衡时c(OH﹣)= ![]() =
= ![]() mol/L=10﹣4 mol/L,则c(H+)=10﹣10 mol/L,所以溶液的pH=﹣lgc(H+)=10,故应调整溶液pH大于10,故答案为:10.
mol/L=10﹣4 mol/L,则c(H+)=10﹣10 mol/L,所以溶液的pH=﹣lgc(H+)=10,故应调整溶液pH大于10,故答案为:10.
(1)碳酸钠为强碱弱酸盐,碳酸根离子水解导致溶液呈碱性;(2)pH=2的盐酸,稀释100倍后溶液的pH变为4;(3)①向H2S溶液中加入NaOH固体时,氢离子的浓度减小,电离平衡向右移动;②向H2S溶液中加入NaHS固体时,硫氢根离子浓度变大,H2S═HS﹣+H+电离平衡向左移动,硫氢根离子的电离,c(S2﹣)增大;(4)醋酸为弱酸,等pH时,醋酸浓度较大,与锌反应时,醋酸进一步电离出氢离子,则醋酸的pH变化较小,醋酸中存在电离平衡,氢离子和锌反应时促进醋酸电离,补充反应的氢离子,pH变化等量时,消耗的锌较多,以此解答;(5)根据c(OH﹣)= ![]() 计算氢氧根离子浓度,从而确定溶液的pH,
计算氢氧根离子浓度,从而确定溶液的pH,


科目:高中化学 来源: 题型:
【题目】室温时,向20mL,0.1mol/L的醋酸溶液中不断滴加0.1mol/L的NaOH溶液,溶液的pH变化曲线如图所示,在滴定过程中,下列关于溶液中离子浓度大小关系的描述不正确的是( ) 
A.a点时:c(CH3COOH)>c(Na+)>c(CH3COO﹣)>c(H+)>c(OH﹣)
B.b点时:c(Na+)=c(CH3COO﹣)
C.c点时:c(OH﹣)=c(CH3COOH)+c(H+)
D.d点时:c(Na+)>c(CH3COO﹣)>c(OH﹣)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. 用托盘天平称取3.2 g NaCl固体
B. 过滤和向容量瓶转移液体时,玻璃棒的作用相同
C. 容量瓶使用前应洗涤、干燥、检漏
D. 定容时,加水不慎超过刻度线,只能重新配置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用某矿渣(含有Cu2O(主要)、Al2O3、Fe2O3、SiO2)提取铜的操作流程如图: 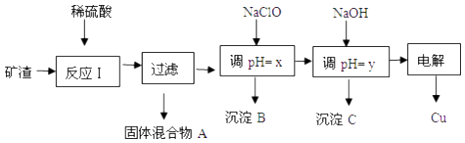
已知:Cu2O+2H+═Cu+Cu2++H2O
沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
(1)固体混合物A中的成分是 .
(2)反应Ⅰ完成后,铁元素的存在形式为 . (填离子符号)请写出生成该离子的离子方程式 .
(3)沉淀B可用于制造铁红,为了保证铁红的质量则x的取值为 .
(4)书写出由沉淀C制备铝的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次增大的A,B,C,D,E,F六种元素.其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为24.
(1)F原子基态的核外电子排布式为 .
(2)在A,B,C三种元素中,第一电离能由大到小的顺序是(用元素符号回答).
(3)元素B的简单气态氢化物的沸点远高于元素A的简单气态氢化物的沸点,其主要原因是 .
(4)由A,B,C形成的离子CAB﹣与AC2互为等电子体,则CAB﹣的结构式为 .
(5)在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为 .
(6)由B,C,D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素. 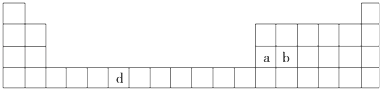
(1)请写出元素d的基态原子电子排布式 .
(2)b元素的氧化物中b与氧元素之间的共价键类型是 . 其中b原子的杂化方式是 .
(3)a单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示. 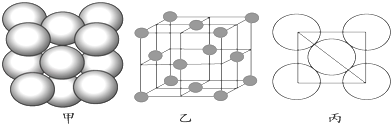
若已知a的原子半径为d,NA代表阿伏加德罗常数,a的相对原子质量为M,则一个晶胞中a原子的数目为 , 该晶体的密度为(用字母表示).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com