
����Ŀ��ijУ��ѧ�о���ѧϰС�������ʵ����֤Fe��Cu�Ľ�����ԣ�����������������ַ��������������������й�ʵ����Ŀ��
�������������������С��ȵ���Ƭ��ͭƬ���ֱ�ͬʱ����ϡ����(��ϡ����)�У��۲�������ݵĿ������ݴ�ȷ�����ǵĻ�ԡ���ԭ�������ӷ���ʽΪ___________________��
����������������Fe��Cu���缫��Ƴ�ԭ��أ���ȷ�����ǵĻ�ԡ���������ķ����ڻ���ԭ���װ��ͼ�����ԭ��صĵ缫���Ϻ͵������Һ����д���缫��Ӧʽ��

������Ӧʽ��____________________��
������Ӧʽ��____________________��
���������������ѧ��֪ʶ���������������һ����֤Fe��Cu��Եļ�ʵ�鷽��(�뷽��������������ͬ)��________________�������ӷ���ʽ��ʾ�䷴Ӧԭ����_____________________��
���𰸡���������Fe��2H��===Fe2����H2����
��������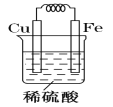 ��2H++2e-=H2����Fe-2e-=Fe2+��������:����Ƭ����CuSO4��Һ�����������渲��һ��ͭ��˵��Fe��Cu���ǿ��Fe��Cu2��===Fe2����Cu(��������)��
��2H++2e-=H2����Fe-2e-=Fe2+��������:����Ƭ����CuSO4��Һ�����������渲��һ��ͭ��˵��Fe��Cu���ǿ��Fe��Cu2��===Fe2����Cu(��������)��
��������
�������������I�����ݽ����˳�����ֻ�����������ϡ���ᷴӦ����Fe��2H��=Fe2����H2��������II�������ǣ�1���ķ�Ӧ��ԭ���װ��Ϊ�� ��������ӦʽΪ2H����2e��=H2����������ӦʽΪFe��2e��=Fe2��������III�����ݽ����˳��������ܰ�ͭ�û���������ˣ�����Ƭ����CuSO4��Һ�����������渲��һ��ͭ��˵��Fe��Cu���ǿ��Fe��Cu2��===Fe2����Cu(��������)��
��������ӦʽΪ2H����2e��=H2����������ӦʽΪFe��2e��=Fe2��������III�����ݽ����˳��������ܰ�ͭ�û���������ˣ�����Ƭ����CuSO4��Һ�����������渲��һ��ͭ��˵��Fe��Cu���ǿ��Fe��Cu2��===Fe2����Cu(��������)��


 �Ƹ�С״Ԫ�������������ϵ�д�
�Ƹ�С״Ԫ�������������ϵ�д� ����һ������ܼƻ�ϵ�д�
����һ������ܼƻ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һƿ��Һ�п��ܺ���Mg2+��Na+��OH����Cl����CO32����SO42����ij���֣��ֱַ�ȡ����Һ����װ����֧�Թܣ���������ʵ�飺
�����һ֧�Թ��НC���̪��Һ����Һ��죻
����ڶ�֧�Թ��м�������BaCl2��Һ�����ɰ�ɫ���������ˣ�������Һ�������֧�Թܣ��ڳ���������ϡ���ᣬ��������ʧ������ɫ��ζ���������������ͨ�����ʯ��ˮ��ʯ��ˮ����ǡ�
�������֧�Թ����ȼ��������ữ���ټ�����������Һ�����ְ�ɫ������ͨ������ʵ����ж���Һ�к�������Ϊ �������е�����Ϊ ����ȷ���Ƿ��е�����Ϊ ��д��ʵ��ڢ��������йط�Ӧ�����ӷ���ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ��������ͼװ����������������ĸ�ʵ�飬�����ﵽʵ��Ŀ����
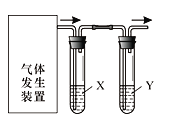
ѡ�� | ʵ��Ŀ�� | �Լ�X | �Լ�Y |
A | ��֤C2H5OH��ŨH2SO4������170�����õ���ϩ������ | NaOH��Һ | Br2ˮ |
B | ����FeSO4���ȷֽ��������������SO3��SO2 | BaCl2��Һ | Ʒ����Һ |
C | ��֤��ʯ�뱥��ʳ��ˮ��Ӧ���ɵ���Ȳ������ | CuSO4��Һ | KMnO4��Һ |
D | ��֤�����ԣ�Cl2��Br2��I2 | NaBr��Һ | KI��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ��Ӧ�������ȷ�Ӧ����
A. ŨH2SO4����ˮ B. ��ʯ������ˮ
C. þ��ϡ���ᷴӦ D. NH4Cl������Ba(OH)2��8H2O���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС�������Ͳ�������ʱ�ͻ�鴤��������ѧ֪ʶ��������ƽʱҪ����
A. ����ˮ�����߲� B. ��Ƭ��ά����D
C. ������Ƥ�ͺ��ܲ� D. �����ʺ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij200 mL�Ȼ�þ���Ȼ������Һ��c(Mg2��)Ϊ0.3 mol/L��c(Cl��)Ϊ1.2 mol/L��ҪʹMg2��ȫ��ת��Ϊ��������������������4 mol/L NaOH��Һ�����Ϊ
A��70 mL B��60mL C��80 mL D��128 mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij���������������As2O3��As2O5������ͼ����Ϣ�ش��������⣺
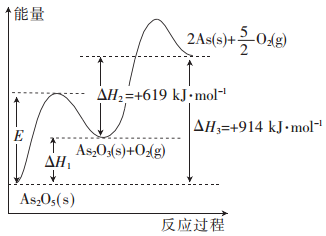
(1)As2O5�ֽ�����As2O3��O2�ķ�Ӧ�У����������E__________������������������С���� ������������ͬ������H1_________��
(2)As2O3�ֽ�����As��O2���Ȼ�ѧ����ʽΪ____________________��
(3)As2O3��O2��Ӧ����As2O5���Ȼ�ѧ����ʽΪ_____________________��
(4)��1 mol As2O5�ֽ�����0.4 mol As2O3��1.2 mol As����÷ֽ�����У������յ�������Ϊ_________kJ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��һ���������ۼ��뵽װ��200 mLijŨ�ȵ�ϡ������Һ�������г�ַ�Ӧ��
��������ʣ��m1 g���ۣ��ռ���NO��״�������Ϊ672 mL��
������Һ�����ʵĻ�ѧʽ ��ԭ������Һ�����ʵ���Ũ�� mol/L��
���������̡�Һ���������μ���ϡ���ᣬֱ�����ٲ���NO����Ϊֹ����ʱ�����л�ʣ������m2 g
���ʱ��Һ�����ʵĻ�ѧʽ ��m1-m2 ��ֵΪ g����ȷ��0.1g )
(2)�����������Խ��Al������ȼ�ϵ��ͨ����NaCl��Һ��KOH��ҺΪ�������Һ��ͨ������ĵ缫Ϊ�������Զ��ʯīΪ�������ϡ�����NaCl��ҺΪ�������Һ�������ķ�ӦʽΪ______________������KOH��ҺΪ�������Һ������ܷ�ӦΪ_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��0.5���ij��̬��ֻ����0.5������������ӳɷ�Ӧ,�����ȴ��飬0.5 mol���ȴ������3 mol����������ȫ��ȡ����Ӧ��������Ľṹ��ʽΪ( )
A��CH2��CH2 B��CH3CH��CH2 C��CH3CH3 D��CH3CH2CH��CH2
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com