
| A、标准状况下,11.2 L NO和11.2 L SO3的分子总数为0.5NA |
| B、0.1molBr2与足量H2O或NaOH反应转移的电子数均为0.1NA |
| C、0.1mol的白磷(P4)或四氯化碳(CCl4)中所含的共价键数均为0.4NA |
| D、在精炼铜或电镀铜的过程中,当阴极析出铜32g转移电子数均为NA |


科目:高中化学 来源: 题型:
 某化学兴趣小组对加碘食盐中的KIO3进行研究,它是一种白色粉末,常温下很稳定,加热至560℃开始分解.在酸性条件下KIO3是一种较强的氧化剂,与HI、H2O2等作用,被还原为碘单质.
某化学兴趣小组对加碘食盐中的KIO3进行研究,它是一种白色粉末,常温下很稳定,加热至560℃开始分解.在酸性条件下KIO3是一种较强的氧化剂,与HI、H2O2等作用,被还原为碘单质.| 滴定次数 | 待测溶液的体积(/mL) | 标准Na2S2O3溶液的体积 | |
| 滴定前读数(/mL) | 滴定后读数(/mL) | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 2.20 | 20.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| 反应时间/min | n(MgSO4)/mol | n(CO)/mol | n(CO2)/mol |
| 0 | 2.00 | 2.00 | 0 |
| 2 | 0.80 | ||
| 4 | 1.20 |
| A、反应在0~2min内的平均速率为v(SO2)=0.6 mol?L-l?min-l |
| B、反应在2~4min内容器内气体的密度没有变化 |
| C、若升高温度,反应的平衡常数变为l.00,则正反应为放热反应 |
| D、保持其他条件不变,起始时向容器中充入1.00mol MgSO4和1.00molCO,到达平衡时n(CO2)>0.60mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、氢氧根离子的电子式是 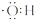 |
B、二氧化碳分子的比例模型是  |
| C、芳香烃的组成通式是CnH2n-6(n≥6) |
D、12C和14C的原子结构示意图均可表示为  |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA |
| B、1molH2O含有的原子数目为3NA |
| C、常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA |
| D、常温常压下,22.4L氯气与足量镁粉充分反应,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2O的摩尔质量是18 |
| B、等质量的O2和O3中所含的氧原子数相同 |
| C、常温下,22.4LNO2中所含的氧原子数为2NA |
| D、4gNaOH溶解于500mL水中,所得溶液的物质的量浓度为0.2mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸酸化的淀粉KI溶液在空气中变成蓝色:4I-+O2+2H2O═2I2+4OH- | ||||
| B、钢铁发生吸氧腐蚀时,正极的电极反应式:O2+4e-+2H2O═4OH- | ||||
C、氨气催化氧化生产硝酸的主要反应:4NH3+7O2
| ||||
| D、向Na2SiO3溶液中通入过量CO2:SiO32-+2CO2+2H2O═H2SiO3+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(M+)>c(A-)>c(OH-)>c(H+) |
| B、c(HA)+c(H+)=c(OH-) |
| C、c(M+)>c(A-)>c(H+)>c(OH-) |
| D、c(M+)=c(A-)+c(HA) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用蒸馏的方法分离汽油和煤油 |
| B、分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| C、浓硫酸稀释时,应将浓硫酸慢慢加到水中,及时搅拌并冷却 |
| D、将O2和H2的混合气体通过灼热的氧化铜,以除去其中的H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com