
 某化学兴趣小组对加碘食盐中的KIO3进行研究,它是一种白色粉末,常温下很稳定,加热至560℃开始分解.在酸性条件下KIO3是一种较强的氧化剂,与HI、H2O2等作用,被还原为碘单质.
某化学兴趣小组对加碘食盐中的KIO3进行研究,它是一种白色粉末,常温下很稳定,加热至560℃开始分解.在酸性条件下KIO3是一种较强的氧化剂,与HI、H2O2等作用,被还原为碘单质.| 滴定次数 | 待测溶液的体积(/mL) | 标准Na2S2O3溶液的体积 | |
| 滴定前读数(/mL) | 滴定后读数(/mL) | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 2.20 | 20.02 |
| 2.00×10-5mol |
| 6 |
| 2.00×10-5mol |
| 6 |
| 127×10-2 |
| 3 |
| ||
W×10-3×
|
| 5080 |
| 3w |
| 5080 |
| 3w |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、热稳定性:Na2CO3>NaHCO3>H2CO3 |
| B、相同pH的溶液,加水稀释后的pH:H2SO4>HCl>CH3COOH |
| C、离子半径:K+>Na+>Mg2+ |
| D、结合H+能力:OH->ClO->NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
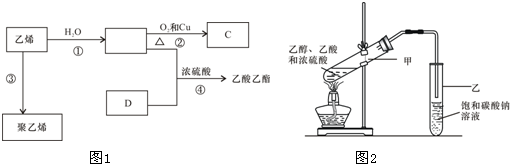
查看答案和解析>>
科目:高中化学 来源: 题型:
| /s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A、反应在前50 S内的平均速率v(PCl3)=0.0032mol/(L?s) |
| B、保持其他条件不变,升高温度,平衡时c(PCl3=0.11)mol?L-1,该反应为放热反应 |
| C、相同温度下,起始时向容器中充入1.0 mol PC15、0.20 mol PC13和0.20 mo1 C12,达到平衡的v(正)>v(逆) |
| D、相同温度下,起始时向容器中充入2.0 mol PC13、2.0 mol C12,达到平衡时,PCl3的转化率小于80% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+)>c(OH-)=c(H+) |
| B、0.4 mol?L-1 CH3COOH溶液与0.2 mol?L-1 NaOH溶液等体积混合:2c(H+)+c(CH3COOH)=c(CH3COO-)+2c(OH-) |
| C、氯水中加入少许NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-) |
| D、NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,11.2 L NO和11.2 L SO3的分子总数为0.5NA |
| B、0.1molBr2与足量H2O或NaOH反应转移的电子数均为0.1NA |
| C、0.1mol的白磷(P4)或四氯化碳(CCl4)中所含的共价键数均为0.4NA |
| D、在精炼铜或电镀铜的过程中,当阴极析出铜32g转移电子数均为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com