
| A、3 | B、4 | C、5 | D、6 |


科目:高中化学 来源: 题型:
| A、推广使用燃煤脱硫技术,防治SO2污染 |
| B、实施绿化工程,防治扬尘污染 |
| C、采用“绿色化学”工艺,使原料尽可能转化为所需要的物质,减少废气排放 |
| D、加大石油、煤炭的开采速度,增加化石燃料的供应量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 浓硫酸 |
| 170℃ |
| 高温高压 |
| 催化剂 |
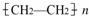
查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学兴趣小组对加碘食盐中的KIO3进行研究,它是一种白色粉末,常温下很稳定,加热至560℃开始分解.在酸性条件下KIO3是一种较强的氧化剂,与HI、H2O2等作用,被还原为碘单质.
某化学兴趣小组对加碘食盐中的KIO3进行研究,它是一种白色粉末,常温下很稳定,加热至560℃开始分解.在酸性条件下KIO3是一种较强的氧化剂,与HI、H2O2等作用,被还原为碘单质.| 滴定次数 | 待测溶液的体积(/mL) | 标准Na2S2O3溶液的体积 | |
| 滴定前读数(/mL) | 滴定后读数(/mL) | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 2.20 | 20.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
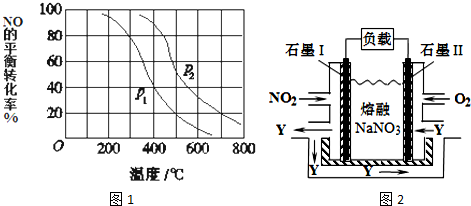
| 50~80℃ |
| 180~200℃ |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| 反应时间/min | n(MgSO4)/mol | n(CO)/mol | n(CO2)/mol |
| 0 | 2.00 | 2.00 | 0 |
| 2 | 0.80 | ||
| 4 | 1.20 |
| A、反应在0~2min内的平均速率为v(SO2)=0.6 mol?L-l?min-l |
| B、反应在2~4min内容器内气体的密度没有变化 |
| C、若升高温度,反应的平衡常数变为l.00,则正反应为放热反应 |
| D、保持其他条件不变,起始时向容器中充入1.00mol MgSO4和1.00molCO,到达平衡时n(CO2)>0.60mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸酸化的淀粉KI溶液在空气中变成蓝色:4I-+O2+2H2O═2I2+4OH- | ||||
| B、钢铁发生吸氧腐蚀时,正极的电极反应式:O2+4e-+2H2O═4OH- | ||||
C、氨气催化氧化生产硝酸的主要反应:4NH3+7O2
| ||||
| D、向Na2SiO3溶液中通入过量CO2:SiO32-+2CO2+2H2O═H2SiO3+CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com