
【题目】铅蓄电池具有电压稳定,性能良好,安全可靠,循环使用等优点。其反应方程式如下式:Pb (s)+ PbO2(s) +2H2SO4(aq) ![]() 2PbSO4(s) +2H2O(l)。
2PbSO4(s) +2H2O(l)。
(1)放电时,负极发生_________反应(填“氧化”或“还原”),其电极反应式为______________________________,
(2)充电时,阳极发生___________反应(填“氧化”或“还原”),其电极反应式为_____________________________。
科目:高中化学 来源: 题型:
【题目】I.下列说法中正确的是 。
A.丙烯分子中有8个σ键,1个π键
B.在SiO2晶体中,1个Si原子和2个O原子形成2个共价键
C.NF3的沸点比NH3的沸点低得多,是因为NH3分子间有氢键,NF3只有范德华力
D.NCl3和BC13分子中,中心原子都采用sp3杂化
II.人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测是钛(Ti),它被誉为“未来世纪的金属”。试回答下列问题:
(1)Ti元素在元素周期表中的位置是第______周期第___ ____族,
其基态原子的电子排布式为________。
(2)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定。偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如图所示,它的化学式是 ,其中Ti4+的氧配位数为 ,Ba2+的氧配位数为 ;

(3)常温下的TiCl4是有刺激性臭味的无色透明液体,熔点-23.2℃,沸点136.2℃,所以TiCl4应是 化合物,其固体是 晶体。TiCl4在潮湿空气中易挥发,水解而冒白烟,这是因为水解后有________生成。
(4)已知Ti3+可形成配位数为6的配合物,其空间构型为正八面体,如下图1所示,我们通常可以用下图2所示的方法来表示其空间构型(其中A表示配体,M表示中心原子)。配位化合物[Co(NH3)4Cl2]的空间构型也为八面体型,它有 种同分异构体,请在下图方框中将其画出。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子化合物 PPTA 树脂、PF 树脂、脲醛树脂合成路线如下。

已知:I.
II.![]() (尿素)氮原子上的氢原子可以像苯酚上的氢原子那样与甲醛发生加成反应,并缩聚成高分子。
(尿素)氮原子上的氢原子可以像苯酚上的氢原子那样与甲醛发生加成反应,并缩聚成高分子。
(1)![]() →B 的反应类型是____________________。
→B 的反应类型是____________________。
(2)条件a选择的化学试剂是____________________。
(3)E中有两种不同化学环境的氢原子,PPTA 树脂的结构简式是____________________。
(4)W中只有一种含氧官能团。下列说法正确的是____________。
a.Y分子中只有一种官能团
b.M与HCHO 互为同系物
c.W的沸点高于C2H6
(5)Y→W 时,条件ⅰ、ⅱ转化的官能团分别是____________、____________。
(6)合成脲醛树脂的化学方程式是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+206.2 kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+247.4 kJ·mol-1
2H2S(g)=2H2(g)+S2(g) ΔH=+169.8 kJ·mol-1
以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为 。
(2)Na2S的水溶液洗患处可以用来治疗由一种小芥虫在皮肤内生活引起的皮肤病,而且用热水配制的Na2S溶液治疗效果更好。请说明原因 ,并写出有关的化学方程式 。
(3)某自来水中含有Ca2+、Mg2+、Na+、K+、HCO、SO、Cl-,长期烧煮上述自来水会在锅炉内形成水垢。锅炉水垢不仅耗费燃料,而且有烧坏锅炉的危险,因此要定期清除锅炉水垢。
已知部分物质20 ℃时的溶解度数据:
物质 | Mg(OH)2 | CaCO3 | MgCO3 | Ca(OH)2 | CaSO4 | MgSO4 |
溶解度/(g/100 g H2O) | 9.0×10-4 | 1.5×10-3 | 1.0×10-2 | 1.7×10-1 | 2.1×10-1 | 26.7 |
①请用化学方程式表示锅炉中的水垢含有Mg(OH)2的原因:______________________。
②锅炉中的水垢所含有的CaSO4不能直接用酸除去,需要加入试剂X,使其转化为易溶于盐酸的物质Y而除去。试剂X是________(填序号)。
A.食醋 B.氯化钡 C.碳酸钠 D.碳酸氢钠
CaSO4能转化为物质Y的原因是(用文字叙述) _______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0。某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,反应达到平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。
2SO3(g) ΔH<0。某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,反应达到平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。

则下列说法正确的是
A.由图甲知,A点SO2的平衡浓度为0.4 mol·L-1
B.由图甲知,B点SO2、O2、SO3的平衡浓度之比为2:1:2
C.达平衡后,缩小容器容积,则反应速率变化图象可以用图乙表示
D.压强为0.50 MPa时,不同温度下SO2转化率与温度关系如丙图,则T2>T1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究有机物一般经过以下几个基本步骤:分离、提纯 → 确定实验式 → 确定分子式 → 确定结构式。有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实 验 步 骤 | 解 释 或 实 验 结 论 |
(1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。 | 试通过计算填空: (1)A的相对分子质量为 。 |
(2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。 | (2)A的分子式为 。 |
(3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 | (3)用结构简式表示A中含有的官能团 |
(4)A的核磁共振氢谱如下图:
| (4)A中含有 种氢原子。 综上所述,A的结构简式为 。 |
(5)两分子A可反应生成一个六元环状化合物 | (5)写出此反应的方程式 。 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)右图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式 。

(2)己知下列热化学方程式:

由此可知反应:![]() 的焓变为 。
的焓变为 。
(3)在一固定体积的密闭容器中,进行如下化学反应
![]() 其化学平衡常数K与t的关系如下表:
其化学平衡常数K与t的关系如下表:

请完成下列问题:
①试比较K1、K2的大小,K1 K2(填写“>”“=”或“<”)
②下列各项能作为判断该反应达到化学平衡状态的依据的是 (填写字母序号)
A.容器内N2、H2、NH3的浓度之比为1:3:2
B.2v(正)(N2)=v(逆)(H2)
C.容器内压强保持不变
D.混合气体的密度保持不变
E.混合气体的平均相对分子质量不再改变
F.混合气体中各成分的浓度不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定。
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。
2NH3(g)+CO2(g)。
实验测得不同温度下的平衡数据列于下表:
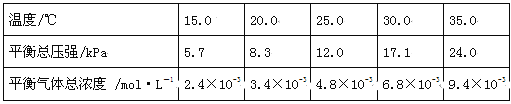
①可以判断该分解反应已经达到平衡的是 。(填编号)
A.2v(NH3)=v(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0℃时的分解平衡常数: 。
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量 (填“增加”,“减少”或“不变”)。
④氨基甲酸铵分解反应的焓变ΔH 0(填“>”、“=”或“<”),熵变ΔS 0(填“>”、“=”或“<”)。
(2)已知:NH2COONH4+2H2![]() NH4HCO3+NH3·H2O,该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间的变化趋势如图所示。
NH4HCO3+NH3·H2O,该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间的变化趋势如图所示。

计算25.0℃时,0~6min 氨基甲酸铵水解反应的平均速率 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2L的密闭容器中进行如下反应:A(g)+2B(g)![]() 3C(g)+nD(g),开始时A为4mol,B为6mol;5min末时测得C的物质的量为3mol,用D表示的化学反应速率v(D)为0.2mol/(L·min)。计算
3C(g)+nD(g),开始时A为4mol,B为6mol;5min末时测得C的物质的量为3mol,用D表示的化学反应速率v(D)为0.2mol/(L·min)。计算
(1)5min末A的物质的量浓度为__________。
(2)前5min内用B表示的化学反应速率v(B)为___________。
(3)化学方程式中n值为__________。
(4)此反应在四种不同情况下的反应速率分别为:
①v(A)=5mol/(L·min) ②v(B)=6mol/(L·min)
③v(C)=4.5mol/(L·min) ④v(D)=8mol/(L·min)
其中反应速率最快的是__________(填编号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com