
【题目】随着科技的进步,合理利用资源、保护环境成为当今社会关注的焦点。甲胺铅碘(CH3NH3PbI3)用作全固态钙钛矿敏化太阳能电池的敏化剂,可由CH3NH2、PbI2及HI为原料合成,制取甲胺的反应为CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g) ΔH。回答下列问题:
CH3NH2(g)+H2O(g) ΔH。回答下列问题:
(1)上述反应中所需的甲醇工业上利用水煤气合成,已知
①CO(g)+![]() O2(g)═CO2(g) △H1=-284kJ/mol
O2(g)═CO2(g) △H1=-284kJ/mol
②H2(g)+![]() O2(g)═H2O(g) △H2=-248kJ/mol
O2(g)═H2O(g) △H2=-248kJ/mol
③CH3OH(g)+![]() O2(g)═CO2(g)+2H2O(g) △H3=-651kJ/mol
O2(g)═CO2(g)+2H2O(g) △H3=-651kJ/mol
CO(g)+2H2(g)![]() CH3OH(g)ΔH=___。
CH3OH(g)ΔH=___。
(2)在一定条件下,将1molCO和2molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
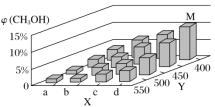
①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为____。
②X轴上b点的数值比a点___(填“大”或“小”)。某同学认为图中Y轴表示温度,你认为他判断的理由是___。
(3)实验室可由四氧化三铅和氢碘酸反应制备难溶的PbI2,常温下,PbI2饱和溶液(呈黄色)中c(Pb2+)=1.0×10-3mol·L-1,则Ksp(PbI2)=___;已知Ksp(PbCl2)=1.6×10-5,则转化反应PbI2(s)+2Cl-(aq)![]() PbCl2(s)+2I-(aq)的平衡常数K=___。
PbCl2(s)+2I-(aq)的平衡常数K=___。
(4)分解HI曲线和液相法制备HI反应曲线分别如图1和图2所示:
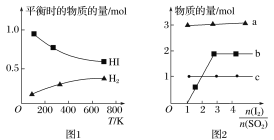
①反应H2(g)+I2(g)![]() 2HI(g)的ΔH__(填大于或小于)0。
2HI(g)的ΔH__(填大于或小于)0。
②将二氧化硫通入碘水中会发生反应:SO2+I2+2H2O![]() 3H++HSO4-+2I-,I2+I-
3H++HSO4-+2I-,I2+I-![]() I3-,图2中曲线a、b分别代表的微粒是___、___(填微粒符号);由图2知要提高碘的还原率,除控制温度外,还可以采取的措施是___。
I3-,图2中曲线a、b分别代表的微粒是___、___(填微粒符号);由图2知要提高碘的还原率,除控制温度外,还可以采取的措施是___。
【答案】-129kJ/mol 25% 大 该反应为放热反应,随着Y值的增大,c(CH3OH)减小,平衡CO(g)+2H2(g)![]() CH3OH(g)向逆反应方向进行,故Y为温度 4×10-9 2.5×10-4 小于 H+ I3- 减小
CH3OH(g)向逆反应方向进行,故Y为温度 4×10-9 2.5×10-4 小于 H+ I3- 减小![]() 的投料比
的投料比
【解析】
(1)①CO(g)+![]() O2(g)═CO2(g) △H1=-284kJ/mol
O2(g)═CO2(g) △H1=-284kJ/mol
②H2(g)+![]() O2(g)═H2O(g) △H2=-248kJ/mol
O2(g)═H2O(g) △H2=-248kJ/mol
③CH3OH(g)+![]() O2(g)═CO2(g)+2H2O(g) △H3=-651kJ/mol
O2(g)═CO2(g)+2H2O(g) △H3=-651kJ/mol
将①+②×2-③得:CO(g)+2H2(g)![]() CH3OH(g) ΔH=-129kJ/mol。
CH3OH(g) ΔH=-129kJ/mol。
答案为:-129kJ/mol;
(2)①平衡时,M点CH3OH的体积分数为10%,
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始量 1mol 2mol 0
变化量 x 2x x
平衡量 1-x 2-2x x
![]() x=0.25mol
x=0.25mol
则CO的转化率为![]() 。
。
答案为:25%;
②因为随着X的增大,甲醇的体积分数增大,说明平衡正向移动,X轴应表示压强。
X轴上b点的数值比a点大。答案为:大;
某同学认为图中Y轴表示温度,他判断的理由是:该反应为放热反应,随着Y值的增大,c(CH3OH)减小,平衡CO(g)+2H2(g)![]() CH3OH(g)向逆反应方向进行,故Y为温度。
CH3OH(g)向逆反应方向进行,故Y为温度。
答案为:该反应为放热反应,随着Y值的增大,c(CH3OH)减小,平衡CO(g)+2H2(g)![]() CH3OH(g)向逆反应方向进行,故Y为温度;
CH3OH(g)向逆反应方向进行,故Y为温度;
(3)实验室可由四氧化三铅和氢碘酸反应制备难溶的PbI2,常温下,PbI2饱和溶液(呈黄色)中c(Pb2+)=1.0×10-3mol·L-1,则Ksp(PbI2)=![]() 。
。
答案为:4×10-9;
已知Ksp(PbCl2)=1.6×10-5,则转化反应PbI2(s)+2Cl-(aq)![]() PbCl2(s)+2I-(aq)的平衡常数K=
PbCl2(s)+2I-(aq)的平衡常数K=![]() 。答案为:2.5×10-4;
。答案为:2.5×10-4;
(4)①因为随着温度的不断升高,HI的物质的量不断减小,所以平衡逆向移动,正反应为放热反应。反应H2(g)+I2(g)![]() 2HI(g)的ΔH小于0。答案为:小于;
2HI(g)的ΔH小于0。答案为:小于;
②将二氧化硫通入碘水中会发生反应:SO2+I2+2H2O![]() 3H++HSO4-+2I-,
3H++HSO4-+2I-,
I2+I-![]() I3-;
I3-;
令投入的SO2为1mol,从反应方程式可以看出,H+的物质的量是SO2的三倍,I-的物质的量是SO2的二倍,再结合图2,即可得出图2中曲线a代表的微粒是H+。答案为:H+;
B代表的微粒是I3-。答案为:I3-;
由图2知要提高碘的还原率,除控制温度外,还可以采取的措施是增大SO2的投入量,同时减少I2的投入量,即减小![]() 的投料比。
的投料比。
答案为:减小![]() 的投料比。
的投料比。


科目:高中化学 来源: 题型:
【题目】某混合物的水溶液中,只可能含有以下离子中的若干种:K+、Mg2+、Fe3+、NH![]() 、Cl-、CO
、Cl-、CO![]() 和SO
和SO![]() 。现每次取10.00 mL进行实验:
。现每次取10.00 mL进行实验:
①第一份加入AgNO3溶液有沉淀产生;
②第二份加入足量NaOH后加热,收集到气体0.672 L (标准状况下);
③第三份加足量BaCl2溶液后得干燥沉淀6.63 g,沉淀经足量盐酸洗涤,干燥后剩4.66 g。
请回答:
(1) c(CO![]() )=____mol·L-1。
)=____mol·L-1。
(2) K+是否存在?_______;若存在,浓度范围是_____(若不存在,则不必回答)。
(3) 根据以上实验:
①不能判断哪些离子是否存在________________;
②若存在这些离子,如何进行检验?_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)、某研究性学习小组,为了探究电极与原电池的电解质之间关系,设计了下列实验方案:用铝片、铜片、镁片作电极,分别与下列溶液构成原电池,并接电流表。
(1)若电解质溶液为0.5mol/L硫酸,电极为铜片和铝片,铝片上的电极的反应式为_________;
(2)若用浓硝酸作电解质溶液,电极为铜片和铝片,铝片为____极(填“正”或“负”)。正极上发生的电极反应式为_________;
(3)若电解质溶液为0.5mol/L氢氧化钠溶液,电极为镁片和铝片,则正极发生的电极反应为______。
(二)、肼(N2H4)又称联氨,在常温下是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气和H2O,放出热量624kJ(25℃时),N2H4完全燃烧的热化学方程式是_______________________________________。肼一空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼一空气燃料电池放电时:正极的电极反应式是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室经常用KMnO4与过量浓盐酸反应制备氯气,化学方程式如下:2KMnO4 + 16HCl(浓) = 2KCl + 2MnCl 2+ 5Cl 2↑ + 8H2O。
(1)用单线桥标出电子转移的方向和数目:__________。
(2)将此反应改写为离子方程式:___________________。
(3)若31.6g KMnO4与过量浓盐酸充分反应,被氧化的HCl的物质的量为_____,在标准状况下生成的Cl 2的体积为____。
(4)用生成的氯气通入下面的装置来验证氯气的某些性质。
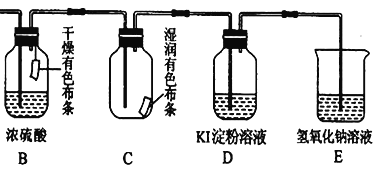
用离子方程式解释C中有色布条褪色的原因:______________,将B、C的顺序颠倒,可否达到原来的实验目的:______(填“可以”或“不可以”);D是用来检验氯气性质的实验,可观察到溶液由无色变为蓝色(I2单质遇淀粉变蓝色),请比较Cl2、I2 、KMnO4 的氧化性,由强到弱为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000mol·L-1NaOH溶液滴定20.00mL0.1000mol·L-1HA溶液所得滴定曲线如图。下列说法不正确的是

A.HA的电离平衡常数Ka=10-5
B.点①所示的溶液中:2c(Na+)=c(A-)+c(HA)
C.点③所示的溶液中:c(HA)>c(OH-)-c(H+)
D.点④所示的溶液中:2c(OH-)-2c(H+)=c(A-)+3c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2.
已知该反应中H2O2只发生如下过程:H2O2―→O2.
①该反应中的还原剂是____________.
②该反应中,发生还原反应的过程是____________→____________.
③写出该反应的化学方程式,并用单线桥标出电子转移的方向和数目_______
④如反应转移了0.3 mol电子,则产生的气体在标准状况下体积为____________
(Ⅱ)已知实验室利用KMnO4溶液和浓盐酸反应制取Cl2,请回答下列问题:
①配平此化学方程式:
____KMnO4+____HCl(浓)— ____KCl+____MnCl2+____Cl2↑+____H2O
②把此化学方程式改写成离子方程式: ________
③被氧化的HCl 与未被氧化的HCl物质的量之比为____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不正确的是( )
A.0.1 mol N2的质量是2.8 g
B.常温常压下,22 g CO2中所含氧原子数约为6.02×1023
C.2 L 0.1mol·L-1NaCl溶液中,c(Na+)=0.2mol·L-1
D.标准状况下,11.2 L O2含有的原子数目约为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氯化硫(S2Cl2)是一种重要的有机合成氯化剂,实验室和工业上都可以用纯净干燥的氯气与二硫化碳反应来制取(CS2+3Cl2![]() CCl4+S2Cl2),其装置如下:
CCl4+S2Cl2),其装置如下:
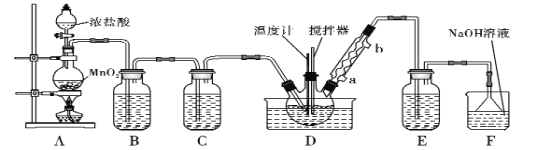
(1)A装置中的离子反应方程式为______________。
(2) 一氯化硫(S2Cl2)常温下较为稳定,受热易分解,易被氧化,且遇水即歧化,歧化产物中不仅有淡黄色固体,而且还有两种气体,用NaOH溶液吸收该气体可得两种盐Na2SO3和NaCl。 写出一氯化硫与水反应的化学反应方程式______________。
(3)B装置的作用是___________________________________。
(4)D中冷凝管的冷水进水口为____(填“a”或“b”);实验过程中,需要先点燃A处酒精灯,通入氯气一段时间后方可向D中水槽里面加入热水加热,这样做的目的是______________。
(5)F装置是用来处理尾气氯气的,已知该吸收反应的氧化产物不仅有NaClO还有NaClO3,且n(NaClO)/n(NaClO3)=3/1,则该反应被还原的氯原子与被氧化的氯原子物质的量之比为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.澄清石灰水与过量碳酸氢钠溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
B.硫酸氢钠溶液中加入氢氧化钡溶液至中性:2H++SO42-+Ba2++2OH﹣=BaSO4↓+2H2O
C.向氢氧化钠溶液中通入足量CO2:2OH-+CO2=CO32-+H2O
D.向明矾[KAl(SO4)2·12H2O]溶液中逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com