
【题目】在透明的强酸性溶液中,能大量共存的离子组是
A. Mg2+、Na+、OH-、SO42- B. K+、Na+、SO42-、HCO3-
C. Ba2+、K+、CO32-、Cl- D. Cu2+、Ca2+、NO3-、Cl-
科目:高中化学 来源: 题型:
【题目】A是石油裂解产物,可做水果催熟剂。已知B分子式为C2H4O,能发生银镜反应。C为有香味,不易溶于水的油状液体。E为常见的调味剂。
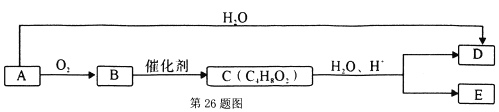
请回答:
(1)有机物E中含有的官能团名称是______________。
(2) A+H2O→D的反应类型是______________。
(3)有机物D在催化剂条件下可与O2反应转化为B,写出化学方程式___________。
(4)下列说法正确的是____。
A.有机物A的聚合物能使酸性KMnO4溶液褪色
B.有机物C中是否混有B可用新制碱性氢氧化铜悬浊液检测
C.C能与NaOH溶液反应,该反应称为皂化反应
D.有机物E生活中可做杀菌剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A. 在金属的冶炼方法中,铝热法,本质上属于热还原法
B. 化学上所说的钢铁,其实钢是钢,铁是铁,钢是混合物,而铁是纯净物
C. 对于反应:FeCuS2 + S![]() FeS2 + CuS,其中FeS2既是氧化产物又是还原产物
FeS2 + CuS,其中FeS2既是氧化产物又是还原产物
D. 已知BrCl的化学性质跟Cl2相似,则BrCl跟水反应(生成HCl和HBrO)也是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)=3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A. v(A)=0.5mol·(L· s)-1 B. v(B)=0.3 mol·(L· s)-1
C. v(C)=0.8 mol·(L· s)-1 D. v(D)=1 mol·(L· s)-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡金属钛、铬、铁、镍、铜等金属及其化合物在工业上有用途。
(1)钛铁合金具有放氢温度低、价格适中等优点,是钛系储氢合金的代表。
①Ti的基态原子价电子排布式为_________。
②Fe元素在周期表中的位置是_________。
(2)制备 CrO2Cl2的反应为 K2Cr2O7+3CCl4=2KCl+2 CrO2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由小到大的顺序________。(用元素符号表示)
②COCl2分子中所有原子均满足8电子构型,COCl2分子中π键和σ键的个数比为____,中心原子的杂化方式为_______。
(3)NiO、FeO的晶体结构均与NaCl的晶体结构相似,其中Ni2+和Fe2+的离子半径分別为6.9×10-2nm和7.8×10-2nm。则熔点:FeO_____(填“>”“<”或“=” )NiO。
(4)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在中国已实现了产业化.该合金的晶胞结构如图所示。

①该晶体的化学式为__________。
②已知该晶胞的摩尔质量为Mg/mol,密度为dg/cm3。设NA为阿伏加徳罗常数的值,则该晶胞的体积是_______(用含M、d、NA的代数式表示)。
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较温定。
已知:a=511pm,c=397pm;标准状况下氢气的密度为8. 98×10-5g/cm3;
![]() 。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为________。
。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列叙述中正确的是
A. 常温下64 g S4和S8混合物中含有原子数为2NA
B. 标准状况下,22.4LHF中含电子数为10NA
C. 标准状况时,2.24LNO和1.12LO2于密闭容器中充分反应后,其分子数为0.1NA
D. 足量铁在1mol氯气中加热反应,铁失去的电子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中,对下列实验事故或药品的处理正确的是( )
A. 汽油失火时,立即用水灭火
B. 加热液体的试管口不能正对着自己或别人
C. 少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液擦洗
D. 实验室中含硫酸的废液可以直接倒入水槽,用水冲入下水道
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com