
【题目】下列指定反应的离子方程式正确的是( )
A.氯化铝溶液中加入过量的氨水:![]()
B.稀硝酸中加入过量铁粉:![]()
C.二氧化锰与浓盐酸混合加热:![]()
D.石灰水中加入过量小苏打溶液![]()
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】铝硅合金材料性能优良。铝土矿(含 30% SiO2、40.8% Al2O3和少量Fe2O3等)干法制取该合金的工艺如下:
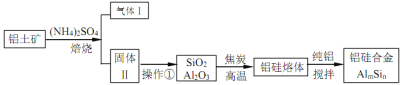
(1)铝硅合金材料中若含铁,会影响其抗腐蚀性。原因是______________。
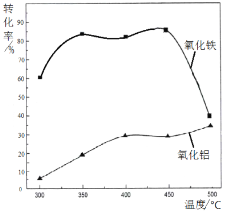
(2)焙烧除铁反应时 Fe2O3 转化为NH4Fe(SO4)2,Al2O3少部分发生类似反应。写出 Fe2O3发生反应的方程式:______________。 氧化物转化为硫酸盐的百分率与温度的关系如图,最适宜焙烧温度为______________。
(3)若操作①中所得溶液中加入过量NaOH 溶液,含铝微粒发生反应的离子方程式为:______________。
(4)用焦炭还原SiO2、Al2O3会产生SiC等中间体。写出中间体 SiC 再与Al2O3反应生成铝、硅单质的化学方程式并表出电子转移的方向和数目:______________ 。
(5)已知25℃时Ksp[Al(OH)3]=1.0×10-33,Ksp[Fe(OH)3]=4.0×10-38。向 FeCl3和 AlCl3的混合溶液中逐滴加入NaOH 溶液,生成 Al(OH)3和Fe(OH)3沉淀,当两种沉淀共存时,上层溶液中 c(Al3+):c(Fe3+)=__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应速率的理解正确的是( )
A.化学反应速率是指单位时间内任一种反应物浓度的减少或生成物浓度的增加
B.化学反应速率是指某一时刻,某种反应物的瞬时速率
C.根据化学反应速率的大小可以知道化学反应进行的快慢
D.对于任何化学反应来说,反应速率越大,反应现象越明显
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在200℃时,将a mol H2(g)和b mol I2(g)充入到体积为V L的密闭容器中,发生反应:I2(g)+H2(g)2HI(g)。
(1)反应刚开始时,由于c(H2)=______,c(I2)=______,而c(HI)=________,所以化学反应速率________最大而________最小(为零)(填“v正”或“v逆”)。
(2)随着反应的进行,反应混合物中各组分浓度的变化趋势为c(H2)________,c(I2)________,而c(HI)________,从而化学反应速率v正________,而v逆________(填“增大”、“减小”或“不变”)。
(3)当反应进行到v正与v逆________时,此可逆反应就达到了最大限度,若保持外界条件不变时,混合物中各组分的物质的量、物质的量浓度、质量分数、体积分数、反应物的转化率和生成物的产率及体系的总压强(或各组分的分压)都将________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或处理事故的方法正确的是( )
A.用干燥的pH试纸测定NaClO溶液的pH
B.在耐高温的石英坩埚中进行熔化氢氧化钠固体的实验
C.用分液漏斗分离乙酸乙酯和水的混合物时,水从下口放出,乙酸乙酯从上口倒出
D.欲配制质量分数为10%的硫酸铜溶液,可准确称取10 g硫酸铜晶体溶于90 g水中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据实验操作和现象所得出的结论正确的是( )
选项 | 实验操作 | 实验现象 | 结论 |
A | 向某溶液中先加入氯水再加入KSCN溶液 | 溶液呈红色 | 原溶液中一定含 |
B | 向盛有 | 试管口出现红棕色气体 |
|
C | 向 | 出现白色胶状沉淀 | 碳的非金属性强于硅的 |
D | 用一束强光照射淀粉溶液 | 产生光亮的“通路” | 淀粉发生水解生成了胶体 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.将AlCl3溶液和Al2(SO4)3溶液分别加热、蒸干、灼烧,所得固体成分相同
B.配制FeSO4溶液时,将FeSO4固体溶于稀盐酸中,然后稀释至所需浓度
C.用加热的方法可以除去KCl溶液中的Fe3+
D.为抑制Fe3+的水解,较好地保存FeCl3溶液,应加少量盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均使用镁片和铝片作电极,但甲同学将电极放入 6mol/L 的硫酸溶液,乙同学将电极放入 6mol/L 的氢氧化钠溶液中,如图所示:
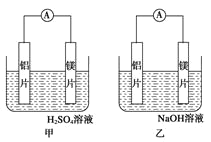
(1)写出甲电池中正极的电极反应式___________________ ;
(2)写出乙池中负极的电极反应式: 负极:_____ 总反应的离子方程式:_________
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金 属,则构成负极材料的金属活泼
,则甲会判断出_____活动性更强,而乙会判断出_____活动性更强(填名称)
(4)由此实验,可得到如下哪些正确结论(_____)
a. 利用原电池反应判断金属活动性顺序时应注意选择合适的介质
b. 镁的金属性不一定比铝的强
c. 该实验说明金属活动性顺序表已过时,已没有利用价值
d. 该实验说明化学研究对象复杂,反应受条件影响较大,因此应具体问题具体分析
(5)上述实验也反过来证明了“直接利用金属活动性顺序表判断原电池中的正负极”这种做法__填 “可靠”或“不可靠”)。如不可靠,请你提出另一个判断原电池正负极的可行实验方案_______________ (如 可靠,可不填)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组对人教版教材实验“在200mL烧杯中放入20g蔗糖(C12H22O11),加入适量水,搅拌均匀,然后再加入15mL质量分数为98%浓硫酸,迅速搅拌”进行如下探究;
(1)观察现象:蔗糖先变黄,再逐渐变黑,体积膨胀,形成疏松多孔的海绵状黑色物质,同时闻到刺激性气味,按压此黑色物质时,感觉较硬,放在水中呈漂浮状态,同学们由上述现象推测出下列结论:
①浓硫酸具有强氧化性 ②浓硫酸具有吸水性 ③浓硫酸具有脱水性④浓硫酸具有酸性 ⑤黑色物质具有强吸附性
其中依据不充分的是_________(填序号);
(2)为了验证蔗糖与浓硫酸反应生成的气态产物,同学们设计了如下装置:

试回答下列问题:
①图1的A中最好选用下列装置_________(填编号);
②图1的 B装置所装试剂是_________;D装置中试剂的作用是_________;E装置中发生的现象是_________;
③图1的A装置中使蔗糖先变黑的化学反应方程式为_________,后体积膨胀的化学方程式为:_________;
④某学生按图2进行实验时,发现D瓶品红不褪色,E装置中有气体逸出,F装置中酸性高锰酸钾溶液颜色变浅,推测F装置中酸性高锰酸钾溶液颜色变浅的原因_________,其反应的离子方程式是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com