
【题目】铝硅合金材料性能优良。铝土矿(含 30% SiO2、40.8% Al2O3和少量Fe2O3等)干法制取该合金的工艺如下:
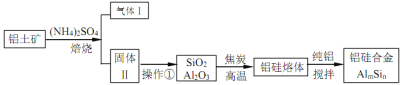
(1)铝硅合金材料中若含铁,会影响其抗腐蚀性。原因是______________。
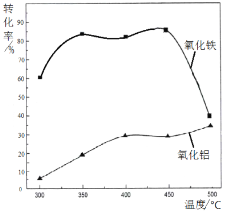
(2)焙烧除铁反应时 Fe2O3 转化为NH4Fe(SO4)2,Al2O3少部分发生类似反应。写出 Fe2O3发生反应的方程式:______________。 氧化物转化为硫酸盐的百分率与温度的关系如图,最适宜焙烧温度为______________。
(3)若操作①中所得溶液中加入过量NaOH 溶液,含铝微粒发生反应的离子方程式为:______________。
(4)用焦炭还原SiO2、Al2O3会产生SiC等中间体。写出中间体 SiC 再与Al2O3反应生成铝、硅单质的化学方程式并表出电子转移的方向和数目:______________ 。
(5)已知25℃时Ksp[Al(OH)3]=1.0×10-33,Ksp[Fe(OH)3]=4.0×10-38。向 FeCl3和 AlCl3的混合溶液中逐滴加入NaOH 溶液,生成 Al(OH)3和Fe(OH)3沉淀,当两种沉淀共存时,上层溶液中 c(Al3+):c(Fe3+)=__________________。
【答案】
(1)铁与铝形成原电池,加快了铝的腐蚀
(2)4(NH4)2SO4 + Fe2O3![]() 2NH4Fe(SO4)2 + 3H2O + 6NH3↑;350℃
2NH4Fe(SO4)2 + 3H2O + 6NH3↑;350℃
(3)Al3++4OH- = AlO2-+2H2O 或Al3++4OH- = Al(OH)4-
(4)![]()
(5)2.5×104
【解析】
试题分析:铝土矿(含30% SiO2、40.8% Al2O3和少量Fe2O3等)加硫酸铵焙烧,Fe2O3转化为NH4Fe(SO4)2同时生成氨气,加水溶解、过滤,滤渣为SiO2和Al2O3,用焦炭在高温条件下还原SiO2、Al2O3得到硅铝熔体,在加纯铝搅拌,得到硅铝合金;
(1)Al、Fe形成原电池,Al活泼性比Fe强的做负极,被腐蚀,所以铝硅合金材料中若含铁,容易发生电化学腐蚀;故答案为:铁与铝形成原电池,加快了铝的腐蚀;
(2)根据题意,焙烧除铁反应时 Fe2O3 转化为NH4Fe(SO4)2,反应的方程式为4(NH4)2SO4 + Fe2O3![]() 2NH4Fe(SO4)2 + 3H2O + 6NH3↑;焙烧时尽可能是氧化铁反应,而氧化铝不反应,由图可知在350℃时,氧化铁转化为硫酸盐的百分率很高,而氧化铝转化为硫酸盐的百分率最低,所以最适宜焙烧温度为350℃;故答案为:4(NH4)2SO4 + Fe2O3
2NH4Fe(SO4)2 + 3H2O + 6NH3↑;焙烧时尽可能是氧化铁反应,而氧化铝不反应,由图可知在350℃时,氧化铁转化为硫酸盐的百分率很高,而氧化铝转化为硫酸盐的百分率最低,所以最适宜焙烧温度为350℃;故答案为:4(NH4)2SO4 + Fe2O3![]() 2NH4Fe(SO4)2 + 3H2O + 6NH3↑;350℃;
2NH4Fe(SO4)2 + 3H2O + 6NH3↑;350℃;
(3)溶液中含有铝离子与氢氧根离子生成偏铝酸根离子,其反应的离子方程式为:Al3++4OH-=AlO2-+2H2O,故答案为:Al3++4OH-=AlO2-+2H2O;
(4)在高温条件下,SiC与Al2O3反应生成Al、Si和CO,其反应的方程式为:3SiC+Al2O3![]() 3Si+2Al+3CO↑;转移18个电子,故答案为:
3Si+2Al+3CO↑;转移18个电子,故答案为:![]() ;
;
(5)当两种沉淀共存时,由于Ksp[Al(OH)3]=c(Al3+)c3(OH-),Ksp[Fe(OH)3]=c(Fe3+)c3(OH-),所以c(Al3+):c(Fe3+)=Ksp[Al(OH)3]:Ksp[Fe(OH)3]=2.5×104,故答案为:2.5×104。


科目:高中化学 来源: 题型:
【题目】25℃时,下列各组离子在指定溶液中一定能大量共存的是
A.能使甲基橙变红的溶液中:K+、Mg2+、NO3-、I-
B.c(HCO3-)=1 mol·L-1溶液中:Na+、NH4+、SO42-、OH-
C.无色透明的溶液中: Fe3+、Al3+、NO3-、SO42-
D.![]() =1012的溶液中:Na+、Ba2+、Cl-、AlO2-
=1012的溶液中:Na+、Ba2+、Cl-、AlO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知可逆反应:M(g)+N(g)P(g)+Q(g) ΔH>0,请回答下列问题:
①在某温度下,反应物的起始浓度分别为c(M)=1 mol·L-1,c(N)=2.4 mol·L-1;达到平衡后,M的转化率为60%,此时N的转化率为________。
②若反应温度不变,反应物的起始浓度分别为c(M)=4 mol·L-1,c(N)=a mol·L-1;达到平衡后,c(P)=2 mol·L-1,a=________。
③若反应温度不变,反应物的起始浓度为c(M)=c(N)=c(P)=c(Q)=2mol·L-1,此时v(正)_________v(逆)(填“>”、“<”或“=”)
(2)合成氨工业对国民经济和社会发展具有重要的意义。其原理为:N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:
①根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越___。
②对于合成氨反应而言,下列有关图象一定正确的是(选填序号)_______。

③相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1 mol N2和3 mol H2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;B中NH3的体积分数为b,放出热量Q2 kJ。则:b ________ a (填“>”、“=”或“<”,下同),Q1________Q2,Q1________92.4。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有室温下四种溶液,下列有关叙述不正确的是( )

A. ③和④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B. ②和③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C. 分别加水稀释10倍,四种溶液的pH:①>②>④>③
D. V1L ④与V2L ①溶液混合后,若混合后溶液pH=7,则V1<V2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家设计出质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫。质子膜H2S燃料电池的结构示意图如下图所示。下列说法不正确的是

A. 电极a为电池的负极
B. 电极b上发生的电极反应为:O2 +4H+ + 4e﹣=== 2H2O
C. 电路中每流过4 mol电子,在正极消耗44.8 LH2S
D. 每17 g H2S参与反应,有1 mol H+经质子膜进入正极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2X(g)+Y(g)![]() 2Z(g)(正反应放热),在不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量(n)与反应时间(t)的关系如图所示。
2Z(g)(正反应放热),在不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量(n)与反应时间(t)的关系如图所示。
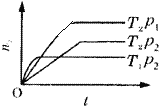
下述判断正确的是( )
A.T1>T2,p1>p2B.T1<T2,p1>p2
C.T1<T2,p1<p2D.T1>T2,p1<p2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上生产硫酸的原料,一种是黄铁矿,其主要成分为FeS2(S为-1价);另一种是磁黄铁矿,其主要成分是Fe1-xS(S为-2价),式中x通常为0.1~0.2,既含有Fe2+又含有Fe3+。
生产硫酸时将矿石煅烧,发生反应如下:
① 4 FeS2+ 11 O2→ 2 Fe2O3+ 8 SO2
② 4 Fe1-xS + (7-3x) O2→ 2 (1-x) Fe2O3+ 4 SO2
(1)含FeS272%的黄铁矿10吨,理论上最多可以生产98%的浓硫酸___________吨(矿石中无其他含硫物质)。
(2)若磁黄铁矿Fe1-xS中x=0.1,则Fe1-xS中Fe2+与Fe3+的物质的量之比为_____:1。
(3)煅烧矿石时,为了尽可能地将矿石中的硫转变为SO2,需通入过量20%的空气(其中N2与O2的体积比为4:1,假设无其他气体成分),计算磁黄铁矿充分煅烧后排出的气体中SO2的体积分数_____(用含x的代数式表示)。
(4)将一定量的磁黄铁矿溶于足量的盐酸,充分反应后测得生成S单质2.4g,FeCl20.425mol,且溶液中无Fe3+,计算Fe1-xS中的x_____值(矿石中其他成分不与盐酸反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
A.放电时负极反应为Zn-2e-+2OH-===Zn(OH)2
B.充电时阳极反应为Fe(OH)3-3e-+5OH-===![]() +4H2O
+4H2O
C.放电时每转移3 mol电子,正极有1 mol K2FeO4被还原
D.放电时正极附近溶液的酸性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.氯化铝溶液中加入过量的氨水:![]()
B.稀硝酸中加入过量铁粉:![]()
C.二氧化锰与浓盐酸混合加热:![]()
D.石灰水中加入过量小苏打溶液![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com