
【题目】反应2X(g)+Y(g)![]() 2Z(g)(正反应放热),在不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量(n)与反应时间(t)的关系如图所示。
2Z(g)(正反应放热),在不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量(n)与反应时间(t)的关系如图所示。
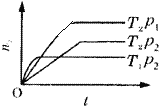
下述判断正确的是( )
A.T1>T2,p1>p2B.T1<T2,p1>p2
C.T1<T2,p1<p2D.T1>T2,p1<p2
科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2、NH4HSO4用途广泛。请回答下列问题:
(1)常温时,0.1 mol·L-1 NH4Al(SO4)2溶液的pH=3。则溶液中c(NH4+)+c(NH3·H2O)_______c (Al3+) + c[Al(OH)3](填“﹥”、“﹤”或“=”);2c(SO42-)- c(NH4+)-3c(Al3+)=________mol·L-1(填数值)。
(2)80℃时,0.1 mol·L-1 NH4Al(SO4)2溶液的pH小于3,分析导致pH随温度变化的原因是________________________ (用离子方程式并结合文字叙述回答)。
(3)常温时,向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加 0.1 mol·L-1 NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示。向NH4HSO4溶液中滴加NaOH溶液到a点的过程中,发生反应的离子方程式为__________________。
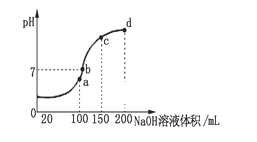
(4)常温时,浓度为0.1 mol·L-1Na HSO4溶液与pH=12的氢氧化钠溶液反应后混合液pH=2则二者体积比为_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在3种不同条件下,分别向容积为2L的恒容密闭容器中充入2molA和1molB,发生反应:2A(g)+B(g)![]() 2C(g) ΔH=QkJ/mol。相关条件和数据见下表:
2C(g) ΔH=QkJ/mol。相关条件和数据见下表:
实验编号 | 实验Ⅰ | 实验Ⅱ | 实验Ⅲ |
反应温度/℃ | 700 | 700 | 750 |
达平衡时间/min | 40 | 5 | 30 |
平衡时n(C)/mol | 1.5 | 1.5 | 1 |
化学平衡常数 | K1 | K2 | K3 |
下列说法正确的是( )
A.K1=K2<K3
B.升高温度能加快反应速率的原因是降低了反应的活化能
C.实验Ⅱ比实验Ⅰ达平衡所需时间小的可能原因是使用了催化剂
D.实验Ⅲ达平衡后,恒温下再向容器中通入1molA和1molC,平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是

A. 用石墨作阳极,铁作阴极
B. 阳极的电极反应式为:Cl- + 2OH--2e-= ClO- + H2O
C. 阴极的电极反应式为:2H2O + 2e- = H2↑ + 2OH-
D. 除去CN-的反应:2CN-+ 5ClO- + 2H+ = N2↑ + 2CO2↑ + 5Cl-+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝硅合金材料性能优良。铝土矿(含 30% SiO2、40.8% Al2O3和少量Fe2O3等)干法制取该合金的工艺如下:
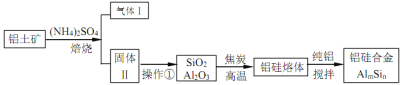
(1)铝硅合金材料中若含铁,会影响其抗腐蚀性。原因是______________。
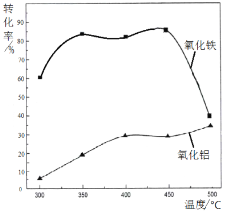
(2)焙烧除铁反应时 Fe2O3 转化为NH4Fe(SO4)2,Al2O3少部分发生类似反应。写出 Fe2O3发生反应的方程式:______________。 氧化物转化为硫酸盐的百分率与温度的关系如图,最适宜焙烧温度为______________。
(3)若操作①中所得溶液中加入过量NaOH 溶液,含铝微粒发生反应的离子方程式为:______________。
(4)用焦炭还原SiO2、Al2O3会产生SiC等中间体。写出中间体 SiC 再与Al2O3反应生成铝、硅单质的化学方程式并表出电子转移的方向和数目:______________ 。
(5)已知25℃时Ksp[Al(OH)3]=1.0×10-33,Ksp[Fe(OH)3]=4.0×10-38。向 FeCl3和 AlCl3的混合溶液中逐滴加入NaOH 溶液,生成 Al(OH)3和Fe(OH)3沉淀,当两种沉淀共存时,上层溶液中 c(Al3+):c(Fe3+)=__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:可逆反应Cu(s)+CO2(g) CuO(s)+CO(g) △H>0
(1)能判断该反应达到平衡的依据是__________。
A.容器内压强保持不变 B.c(CO)保持不变
C.υ正(CO2)=υ逆(CO) D.c(CO2)=c(CO)
(2)该反应的平衡常数表达式为_________________ ;若该反应在体积固定的密闭容器中进行,反应物为过量Cu(s)和CO2,在一定条件下达到平衡状态,如果改变下列条件再达平衡
Ⅰ.升高温度,CO的平衡浓度__________(选填“增大”、“减小”、“不变”下同)
Ⅱ.再通入CO2,CO2的平衡转化率___________
(3)该反应的逆反应速率随时间变化情况如图:从图中看到,反应在t2时达平衡,在t1时改变了某种条件,改变的条件可能是_______________
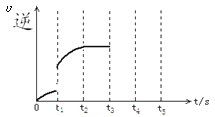
a.升温 b.增大CO2的浓度 c.使用催化剂 d.增压
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了社会可持续发展,化工生产过程应尽量减少对环境的副作用。“绿色化学”是当今社会提出的一个新概念,它要求从经济、环保和技术上设计可行的化学反应,据此,由单质铜制取硝酸铜的下列衍变关系可行且符合“绿色化学”的是( )
A.Cu![]() Cu(NO3)2
Cu(NO3)2
B.Cu![]() CuO
CuO![]() Cu(NO3)2
Cu(NO3)2
C.Cu![]() CuO
CuO![]() Cu(OH)2
Cu(OH)2![]() Cu(NO3)2
Cu(NO3)2
D.Cu![]() CuSO4
CuSO4![]() 2Cu(NO3)2
2Cu(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1 mol·L-1的CH3COOH溶液滴定20 mL 0.1 mol·L-1的NaOH溶液,当滴加V mL CH3COOH溶液时,混合溶液的pH=7。已知CH3COOH的电离平衡常数为Ka,忽略混合时溶液体积的变化,下列关系式正确的是( )
A.Ka=![]() B.V=
B.V=![]() C.Ka=
C.Ka=![]() D.Ka=
D.Ka=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据实验操作和现象所得出的结论正确的是( )
选项 | 实验操作 | 实验现象 | 结论 |
A | 向某溶液中先加入氯水再加入KSCN溶液 | 溶液呈红色 | 原溶液中一定含 |
B | 向盛有 | 试管口出现红棕色气体 |
|
C | 向 | 出现白色胶状沉淀 | 碳的非金属性强于硅的 |
D | 用一束强光照射淀粉溶液 | 产生光亮的“通路” | 淀粉发生水解生成了胶体 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com