
【题目】NH4Al(SO4)2、NH4HSO4用途广泛。请回答下列问题:
(1)常温时,0.1 mol·L-1 NH4Al(SO4)2溶液的pH=3。则溶液中c(NH4+)+c(NH3·H2O)_______c (Al3+) + c[Al(OH)3](填“﹥”、“﹤”或“=”);2c(SO42-)- c(NH4+)-3c(Al3+)=________mol·L-1(填数值)。
(2)80℃时,0.1 mol·L-1 NH4Al(SO4)2溶液的pH小于3,分析导致pH随温度变化的原因是________________________ (用离子方程式并结合文字叙述回答)。
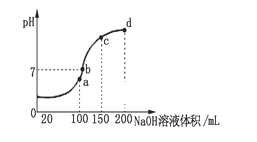
(3)常温时,向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加 0.1 mol·L-1 NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示。向NH4HSO4溶液中滴加NaOH溶液到a点的过程中,发生反应的离子方程式为__________________。
(4)常温时,浓度为0.1 mol·L-1Na HSO4溶液与pH=12的氢氧化钠溶液反应后混合液pH=2则二者体积比为_____________
【答案】= l.0×l0-3(或l.0×l0-3-l.0×l0-11) Al3+、NH4+存在水解平衡:Al3++3H2O![]() Al(OH)3+3H+、NH4++H2O
Al(OH)3+3H+、NH4++H2O![]() NH3·H2O+H+,升高温度其水解程度增大,c(H+)增大,pH减小 H++OH-=== H2O 9:2
NH3·H2O+H+,升高温度其水解程度增大,c(H+)增大,pH减小 H++OH-=== H2O 9:2
【解析】
(1)由物料守恒知,NH4Al(SO4)2中NH4+和Al3+物质的量相等,故c(NH4+)+c(NH3H2O)和c(Al3+)+c[Al(OH)3]相等;由电荷守恒:2c(SO42-)+c(OH-)=c(NH4+)+3c(Al3+)+c(H+),由此分析解答;
(2)温度升高会促进NH4+和Al3+水解,从而导致氢离子浓度变大,pH降低;
(3)向100mL0.1molL-1NH4HSO4溶液中滴加0.1molL-1NaOH溶液100mL时,仅发生氢离子和氢氧根离子的中和反应;
(4)常温时,浓度为0.1 mol·L-1Na HSO4溶液中c(H+)=0.1mol/L, pH=12的氢氧化钠溶液中c(OH-)=0.01mol/L,反应后混合液pH=2,即c(H+)=0.01mol/L。
(1)由物料守恒知,NH4Al(SO4)2中NH4+和Al3+物质的量相等,故c(NH4+)+c(NH3H2O)和c(Al3+)+c[Al(OH)3]相等;由电荷守恒:2c(SO42-)+c(OH-)=c(NH4+)+3c(Al3+)+c(H+),所以2c(SO42-)-c(NH4+)-3c(Al3+)=c(H+)-c(OH-)=l.0×l0-3(或l.0×l0-3-l.0×l0-11);
(2)Al3+、NH4+存在水解平衡:Al3++3H2OAl(OH)3+3H+、NH4++H2ONH3H2O+H+,升高温度其水解程度增大,c(H+)增大,pH减小;
(3)向100mL0.1molL-1NH4HSO4溶液中滴加0.1molL-1NaOH溶液100mL时,仅发生氢离子和氢氧根离子的中和反应,离子方程式为H++OH-=H2O;
(4)常温时,浓度为0.1 mol·L-1Na HSO4溶液中c(H+)=0.1mol/L, pH=12的氢氧化钠溶液中c(OH-)=0.01mol/L,反应后混合液pH=2,即c(H+)=0.01mol/L,设Na HSO4溶液体积为aL,pH=12的氢氧化钠溶液体积为bL,则混合后溶液中c(H+)=![]() =0.01mol/L,解得:a:b=9:2。
=0.01mol/L,解得:a:b=9:2。


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
【题目】已知298K时下列物质的溶度积
CH3COOAg | AgCl | AgCrO4 | AgS | |
Ksp | 2.3×10-3 | 1.77×10-10 | 1.12×10-12 | 6.7×10-15 |
下列说法正确的是( )
A.等体积浓度均为0.02molL-1的CH3COONa和AgNO3溶液混合能产生沉淀
B.浓度均为0.01molL-1的CrO42-和Cl-混合溶液中慢慢滴入AgNO3溶液时,CrO42-先沉淀
C.在CH3COOAg悬浊液中加入盐酸发生反应的离子方程式:CH3COOAg+H++C1-=CH3COOH+AgCl
D.298K时,上述四种饱和溶液的物质的量浓度:c(CH3COOAg)>c(AgCl)>c(Ag2CrO4)>c(Ag2S)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是用0.1000mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置.请回答:
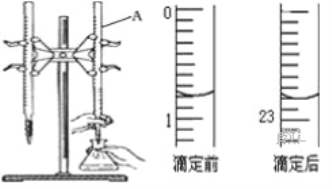
(1)仪器A的名称是__________________;
(2)盐酸滴定管中滴定后读数为_____________mL;
(3)某实验小组同学的三次实验的实验数据如下表所示.根据表中数据计算出的待测NaOH溶液的浓度是________________;(保留四位有效数字)
实验 编号 | 待测NaOH溶液的体积(mL) | 滴定前盐酸的 体积读数(mL) | 滴定后盐酸的 体积读数(mL) |
1 | 20.00 | 1.20 | 23.22 |
2 | 20.00 | 2.21 | 24.21 |
3 | 20.00 | 1.50 | 23.48 |
(4)滴定操作可分解为如下几步(所用的仪器刚用蒸馏水洗净):
A.用碱式滴定管向锥形瓶里注入20.00mL待测NaOH溶液,并加入2~3滴酚酞;
B.用标准溶液润洗酸式滴定管2~3次;
C.把盛有标准溶液的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液,使管内无气泡;
D.取标准盐酸注入酸式滴定管至刻度0以上2~3cm;
E.调节液面至0或0以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准盐酸滴定至终点并记下滴定管液面的刻度。
正确操作步骤的顺序是(用序号字母填写)_____________;
(5)判断到达滴定终点的实验现象是________________________________;
(6)滴定操作时,如果上述B步骤省略,对测定结果的影响是_____(填“无影响”、“偏高”或“偏低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温时,0.1mol·L-1某一元酸HA的电离平衡常数约为1×10-7,下列叙述错误的是( )
A. 该溶液的pH=4
B. 此溶液中,HA约有0.1%发生电离
C. 加水稀释,HA的电离平衡向右移动,HA的电离平衡常数增大
D. 由HA电离出的c(H+)约为水电离出的c(H+)的106倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列各组离子在指定溶液中一定能大量共存的是
A.能使甲基橙变红的溶液中:K+、Mg2+、NO3-、I-
B.c(HCO3-)=1 mol·L-1溶液中:Na+、NH4+、SO42-、OH-
C.无色透明的溶液中: Fe3+、Al3+、NO3-、SO42-
D.![]() =1012的溶液中:Na+、Ba2+、Cl-、AlO2-
=1012的溶液中:Na+、Ba2+、Cl-、AlO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于 2NaOH(s)+H2SO4(aq)→Na2SO4(aq)+2H2O(l)+Q kJ 说法正确的是( )
A.NaOH(s)溶于水的过程中扩散吸收的能量大于水合释放的能量
B.Q<0
C.NaOH(s)+1/2H2SO4(aq)→1/2Na2SO4(aq)+H2O(l)+1/2QkJ
D.若将上述反应中的NaOH(s)换成NaOH(aq),则Q′>Q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述中正确的是()

A. 断裂1 mol A—A和1 mol B—B键,放出a kJ能量
B. 每生成2 mol AB(g)吸收b kJ能量
C. 该反应中反应物的总能量高于生成物的总能量
D. 该反应热ΔH=(a-b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素周期表的一部分,其中A、B、C、D、E代表元素。下列说法错误的是

A.元素B、D对应族①处的标识为ⅥA16
B.熔点:D的氧化物<C的氧化物
C.AE3分子中所有原子都满足8电子稳定结构
D.E的含氧酸酸性强于D的含氧酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2X(g)+Y(g)![]() 2Z(g)(正反应放热),在不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量(n)与反应时间(t)的关系如图所示。
2Z(g)(正反应放热),在不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量(n)与反应时间(t)的关系如图所示。
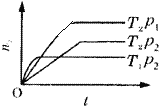
下述判断正确的是( )
A.T1>T2,p1>p2B.T1<T2,p1>p2
C.T1<T2,p1<p2D.T1>T2,p1<p2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com