
【题目】已知室温时,0.1mol·L-1某一元酸HA的电离平衡常数约为1×10-7,下列叙述错误的是( )
A. 该溶液的pH=4
B. 此溶液中,HA约有0.1%发生电离
C. 加水稀释,HA的电离平衡向右移动,HA的电离平衡常数增大
D. 由HA电离出的c(H+)约为水电离出的c(H+)的106倍
【答案】C
【解析】
A.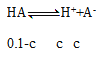 ,则
,则![]() =K=1×10-7,因c很小,故0.1-c可看作0.1,解得c=1×10-4 mol·L-1,所以pH=4,故A正确;
=K=1×10-7,因c很小,故0.1-c可看作0.1,解得c=1×10-4 mol·L-1,所以pH=4,故A正确;
B.HA有![]() ×100%=0.1%发生电离,故B项正确;
×100%=0.1%发生电离,故B项正确;
C.电离平衡常数只与温度有关,温度不变,电离平衡常数不变,C项错误;
D.溶液中的c(H+) =1×10-4 mol·L-1,包括HA电离出来的H+和水电离出来的H+,溶液中的OH-全部来自于水,故由水电离的OH-就是溶液中的OH-,溶液中c(OH-) =1×10-10mol·L-1,所以由水电离出的c(H+)约为1×10-10mol·L-1,忽略由水电离的H+,由HA电离出的c(H+) ≈1×10-4 mol·L-1,为水电离出的c(H+)的106倍,D项正确;
故选C。


科目:高中化学 来源: 题型:
【题目】(一)在微生物作用的条件下,NH4+经过两步反应被氧化成 NO3-。两步反应的能量变化示意图如下:
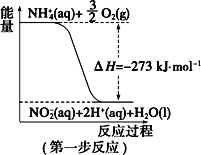
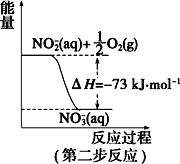
(1)第一步反应是_________(填“放热”或“吸热”)反应。
(2)1 mol NH4+ (aq)全部氧化成NO3- (aq)的热化学方程式是___________。
(二)用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如图所示。
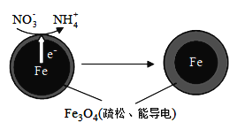
①作负极的物质化学式为___________。
②正极的电极反应式是_______________。
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3-的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3-的去除率低。其原因是_______________。
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3-的去除率。对Fe2+的作用提出两种假设:
Ⅰ.Fe2+直接还原NO3-;
Ⅱ.Fe2+破坏FeO(OH)氧化层。
①做对比实验,结果如图所示,可得到的结论是_________。

②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4,该反应的离子方程式为_________解释加入Fe2+提高NO3-去除率的原因:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将3molA气体和1molB气体通入一密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)请填写下列空白:
xC(g)请填写下列空白:
(1)若容器体积固定为2L,反应2min时测得剩余0.6molB,C的浓度为0.4mol/L。
①2min内,A的平均反应速率为________;x=_______;
②若反应经4min达到平衡,平衡时C的浓度__________0.8mol/L填“大于”、“等于”或“小于”![]() ;
;
(2)若维持容器压强不变:达到平衡时C的体积分数________22%填“大于”、“等于”或“小于”![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】邻苯二甲酸(用H2A表示)为二元弱酸,常温下,Ka1=1.1×10-3,Ka2=3.9×10-6,室温下用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.100 0 mol·L-1 H2A溶液至终点。滴定过程得到的下列溶液中微粒的物质的量浓度关系一定正确的是
A.滴加20 mL NaOH溶液时:c(OH-)>c(H+)+c(H2A )-2c(A2-)
B.pH=7的溶液:c(Na+)<0.050 00 mol·L-1+c(A2-) -c(H2A)
C.滴定过程中可能会出现:c(Na+)>c(HA-)=c(A2-)>c(OH-)>c(H+)
D.滴加40 mL NaOH溶液时:2c(Na+)=c(H2A)+c(A2-)+c(HA-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下列装置进行有关Cl2的实验。下列说法不正确的是


A. Ⅰ图中:实验现象证明氯气无漂白作用,氯水有漂白作用
B. Ⅱ图中:闻Cl2的气味
C. Ⅲ图中:生成棕黄色的烟
D. Ⅳ图中:若气球干瘪,证明Cl2可与NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量。经测定,加入的NaOH的物质的量(mol)和所得沉淀的物质的量(mol)的关系如下图所示。
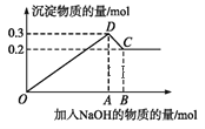
(1)写出下列线段内发生反应的离子方程式:
OD段_________________________,
CD段_________________________。
(2)原溶液中Mg2+、Al3+的物质的量浓度之比为____________。
(3)图中C点横坐标为_______ 。
(4)图中线段OA∶AB=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁二酮肟可用于镍的检验和测定,其结构式如图:
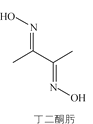
(1)Ni元素基态原子价电子排布式为________,C、N、O第一电离能由大到小的顺序是________。
(2)1mol丁二酮肟含有的σ键数目是________,碳原子的杂化方式为________。
(3)丁二酮肟镍分子内含有的作用力有________(填字母)。
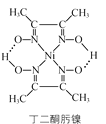
a.配位键 b. 离子键 c. 氢键 d. 范德华力
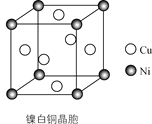
(4)某镍白铜的晶胞如图所示,其化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL0.1mol·L-1KCl溶液和10mL0.1mol·L-1K2CrO4溶液中分别滴加0.1mol·L-1AgNO3溶液。滴加过程中pM[表示-lgc(Cl-)或-lgc(CrO42-)]与所加AgNO3溶液体积之间的关系如下图所示。已知Ag2CrO4为砖红色沉淀,下列说法不合理的是
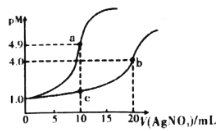
A.bc所在曲线对应K2CrO4溶液
B.常温下,Ksp(Ag2CrO4)<Ksp(AgCl)
C.溶液中c(Ag+)的大小:a点>b点
D.用0.1mol·L-1AgNO3标准液滴定上述KCl、K2CrO4溶液时,Cl-先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH4(g)+2H2S(g) ![]() CS2(g)+4H2(g)。向恒容密闭容器中充入0.1 mol CH4和0.2 mol H2S发生反应,各物质的物质的量分数随温度变化如图所示:
CS2(g)+4H2(g)。向恒容密闭容器中充入0.1 mol CH4和0.2 mol H2S发生反应,各物质的物质的量分数随温度变化如图所示:
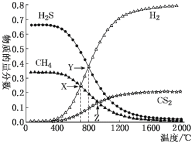
下列说法正确的是
A.该反应的ΔH<0
B.X点与Y点容器内压强比为55∶51
C.X点CH4的转化率为20%
D.维持Z点温度,向容器中再充入CH4、H2S、CS2、H2 各0.1 mol 时υ(正)<υ(逆)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com