
【题目】(一)在微生物作用的条件下,NH4+经过两步反应被氧化成 NO3-。两步反应的能量变化示意图如下:
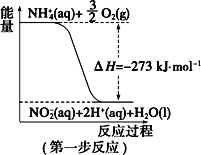
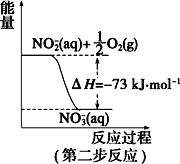
(1)第一步反应是_________(填“放热”或“吸热”)反应。
(2)1 mol NH4+ (aq)全部氧化成NO3- (aq)的热化学方程式是___________。
(二)用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如图所示。
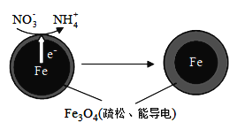
①作负极的物质化学式为___________。
②正极的电极反应式是_______________。
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3-的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3-的去除率低。其原因是_______________。
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3-的去除率。对Fe2+的作用提出两种假设:
Ⅰ.Fe2+直接还原NO3-;
Ⅱ.Fe2+破坏FeO(OH)氧化层。
①做对比实验,结果如图所示,可得到的结论是_________。

②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4,该反应的离子方程式为_________解释加入Fe2+提高NO3-去除率的原因:________。
【答案】放热 ![]() (aq)+2O2(g)=NO
(aq)+2O2(g)=NO![]() (aq)+2H+(aq)+H2O(l) ΔH=-346 kJ·mol-1 Fe NO3-+8e-+10H+=NH4++3H2O FeO(OH)不导电,阻碍电子转移 本实验条件下,Fe2+不能直接还原NO3-;在Fe和Fe2+共同作用下能提高NO3-的去除率 Fe2++2FeO(OH)=Fe3O4+2H+ Fe2+将不导电的FeO(OH)转化为可导电的Fe3O4,利于电子转移
(aq)+2H+(aq)+H2O(l) ΔH=-346 kJ·mol-1 Fe NO3-+8e-+10H+=NH4++3H2O FeO(OH)不导电,阻碍电子转移 本实验条件下,Fe2+不能直接还原NO3-;在Fe和Fe2+共同作用下能提高NO3-的去除率 Fe2++2FeO(OH)=Fe3O4+2H+ Fe2+将不导电的FeO(OH)转化为可导电的Fe3O4,利于电子转移
【解析】
(一)(1)根据图象可知,第一步反应的反应物能量高于生成物;(2)1mol NH4+(aq)全部氧化成NO3-(aq)可由两步反应加和得到;
(二)(1)①Fe还原水体中NO3-,根据题意Fe3O4为电解质,则Fe作还原剂,失去电子,作负极;②NO3-在正极得电子发生还原反应产生NH4+,据此书写电极反应式;
(2)由于Fe3O4为电解质,而电解质的主要作用是为电子转移提供媒介,结合FeO(OH)不导电分析解答;
(3)①根据图中的三个实验结果进行分析,单独加入Fe2+时,NO3-的去除率为0,而Fe和Fe2+共同加入时NO3-的去除率比单独加入Fe高;②结合铁的最终物质形态的导电差异分析解答。
(一)(1)根据图象可知,第一步反应中反应物能量高于生成物,依据能量守恒分析可知反应为放热反应,故答案为:放热;
(2)1mol NH4+(aq)全部氧化成NO3-(aq)可由两步反应加和得到,热化学方程式为NH4+(aq)+2O2(g)=2H+(aq)+H2O(l)+NO3-(aq)△H=(-273kJ/mol)+(-73kJ/mol)=-346kJ/mol,故答案为:NH4+(aq)+2O2(g)=2H+(aq)+H2O(l)+NO3-(aq)△H=-346kJ/mol
(二)(1)①Fe还原水体中NO3-,Fe3O4为电解质,则Fe作还原剂,失去电子,作负极,故答案为:铁;
②NO3-在正极得电子,发生还原反应产生NH4+,则正极的电极反应式为:NO3-+8e-+10H+=NH4++3H2O,故答案为:NO3-+8e-+10H+=NH4++3H2O;
(2)根据实验,pH越高,Fe3+越易水解生成FeO(OH),而FeO(OH)不导电,将铁全部覆盖,阻碍电子转移,所以NO3-的去除率低,故答案为:FeO(OH)不导电,阻碍电子转移;
(3)①从实验结果可以看出,单独加入Fe2+时,NO3-的去除率为0,因此得出Fe2+不能直接还原NO3-;而Fe和Fe2+共同加入时NO3-的去除率比单独加入Fe高,因此可以得出结论:本实验条件下,Fe2+不能直接还原NO3-;在Fe和Fe2+共同作用下能提高NO3-的去除率,故答案为:本实验条件下,Fe2+不能直接还原NO3-;在Fe和Fe2+共同作用下能提高NO3-的去除率;
②同位素示踪法证实了Fe2+能与FeO(OH)反应生成Fe3O4,反应的离子方程式为:Fe2++2FeO(OH)=Fe3O4+2H+,Fe2+将不导电的FeO(OH)转化为可导电的Fe3O4,利于电子转移,因此加入Fe2+可以提高NO3-去除率,故答案为:Fe2++2FeO(OH)=Fe3O4+2H+;Fe2+将不导电的FeO(OH)转化为可导电的Fe3O4,利于电子转移。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】我国的青海省有许多盐湖盛产食盐,人类与食盐关系密切,食盐在老百姓生活和现代社会的工农业生产中均有重要作用。粗盐中含Ca2+、Mg2+、SO42-以及泥沙等杂质,为了除去可溶性杂质,有以下实验步骤进行提纯:
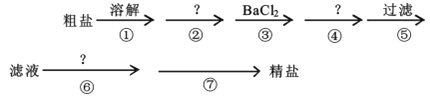
(1)④步所加试剂是___。
(2)第⑥步发生反应的离子方程式为___、___。
(3)第⑦步的操作名称___,需要的玻璃仪器有___、___。
(4)通过步骤⑤中过滤后的滤液,检验SO42-已除尽的操作方法是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组模拟工业上从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3等杂质)中提取氧化铝的工艺做实验,流程如下:
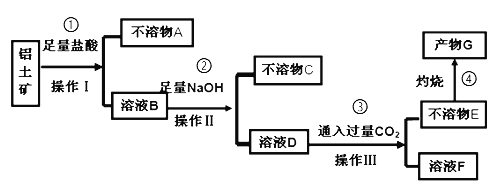
请回答下列问题:
(1)操作Ⅰ的名称为_________。
(2)验证溶液B中是否含有Fe3+的方法:_______________________________。
(3)不溶物A是_____(填化学式),写出③中D→E反应的离子方程式_____________________________。
(4)步骤②中加入过量NaOH溶液发生反应的离子方程式,除了H++OH﹣=H2O、Fe3++3OH﹣=Fe(OH)3↓还有______________________________。
(5)如果铝土矿10g,步骤④中灼烧后得不溶物G质量为5.1g,则矿石中铝元素的含量为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验结论与实验操作及现象相符的一组是( )
选项 | 实验操作及现象 | 实验结论 |
A. | 向某溶液中加入HCl 溶液,产生的气体使澄清的石灰水变浑浊 | 该溶液中含有CO32- |
B. | 向某溶液中通入Cl2,再加入KSCN溶液,溶液变红 | 该溶液中一定含有Fe2+ |
C. | 铁粉加入CuSO4溶液中,析出红色固体 | 氧化性:Fe2+ > Cu2+ |
D. | 向FeCl3溶液中滴加浓的维生素C溶液,黄色褪去 | 维生素C具有还原性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把Na2CO3和NaHCO3的混合物27.4g加热到质量不再变化时,得残留固体21.2g。求原混合物中NaHCO3和Na2CO3的质量之比为( )
A.53∶84B.1∶1C.84∶53D.42∶53
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学方程式的说法正确的是
A. H2的燃烧热为285.8 kJ·mol1,则表示H2燃烧的热化学方程式可表示为:H2(g)+ ![]() O2
O2![]() H2O(g) ΔH=285.8 kJ·mol1
H2O(g) ΔH=285.8 kJ·mol1
B. 中和热为57.3 kJ·mol1,则NaOH与醋酸反应的中和热可以表示如下:NaOH(aq)+CH3COOH(aq)![]() CH3COONa(aq)+H2O(l) ΔH=57.3 kJ·mol1
CH3COONa(aq)+H2O(l) ΔH=57.3 kJ·mol1
C. 已知:C(s,金刚石)+O2(g)![]() CO2(g) ΔH=395.4 kJ·mol1,C(s,石墨)+O2(g)
CO2(g) ΔH=395.4 kJ·mol1,C(s,石墨)+O2(g)![]() CO2(g) ΔH=393.5 kJ·mol1,则C(s,金刚石)
CO2(g) ΔH=393.5 kJ·mol1,则C(s,金刚石)![]() C(s,石墨)ΔH=1.9 kJ·mol1
C(s,石墨)ΔH=1.9 kJ·mol1
D. 已知1 mol CH4完全燃烧生成CO2和液态水放出890.4 kJ的热量,则该反应中转移1 mol电子时放出的热量为222.6 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2A(g)+B(g)![]() 2C(g)+2D(g) 在4种不同情况下反应速率分别如下,其中反应速率v最大的是
2C(g)+2D(g) 在4种不同情况下反应速率分别如下,其中反应速率v最大的是
A. v(A)=0.15mol·(L·min) -1B. v (B)=0.2 mol·(L·min) -1
C. v (C)=0.3 mol·(L·min) -1D. v (D)=0.1 mol·(L·min) -1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素。霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾。
(1)SO2在烟尘的催化下形成硫酸的反应方程式是_____。
(2)NOx和SO2在空气中存在下列平衡:
2NO(g)+O2(g)![]() 2NO2(g) △H=-113.0kJmol-1
2NO2(g) △H=-113.0kJmol-1
2SO2(g)+O2(g)![]() 2SO3(g) △H=-196.6kJmol-1
2SO3(g) △H=-196.6kJmol-1
SO2通常在二氧化氮的存在下,进一步被氧化,生成SO3。
①写出NO2和SO2反应的热化学方程式为_____。
②随温度升高,该反应化学平衡常数变化趋势是____。
(3)提高2SO2+O2![]() 2SO3反应中SO2的转化率,是减少SO2排放的有效措施。
2SO3反应中SO2的转化率,是减少SO2排放的有效措施。
①T温度时,在1L的密闭容器中加入2.0molSO2和1.0molO2,5min后反应达到平衡,二氧化硫的转化率为50%,该反应的平衡常数是___。
②在①中条件下,反应达到平衡后,改变下列条件,能使SO2的转化率提高的是____(填字母)。
a.温度和容器体积不变,充入1.0molHe
b.温度和容器体积不变,充入1.0molO2
c.在其他条件不变时,减少容器的体积
d.在其他条件不变时,改用高效催化剂
e.在其他条件不变时,升高体系温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温时,0.1mol·L-1某一元酸HA的电离平衡常数约为1×10-7,下列叙述错误的是( )
A. 该溶液的pH=4
B. 此溶液中,HA约有0.1%发生电离
C. 加水稀释,HA的电离平衡向右移动,HA的电离平衡常数增大
D. 由HA电离出的c(H+)约为水电离出的c(H+)的106倍
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com