
【题目】如图为元素周期表的一部分,其中A、B、C、D、E代表元素。下列说法错误的是

A.元素B、D对应族①处的标识为ⅥA16
B.熔点:D的氧化物<C的氧化物
C.AE3分子中所有原子都满足8电子稳定结构
D.E的含氧酸酸性强于D的含氧酸
科目:高中化学 来源: 题型:
【题目】二甲醚是一种重要的清洁燃料。合成二甲醚是解决能源危机的研究方向之一。
(1)用CO2和H2可以合成二甲醚(CH3OCH3)
已知:CO(g)+2H2(g)=CH3OH(g) △H1=-90.1kJ/mol
CO(g)+H2O(g)=CO2(g)+H2(g) △H2=-41.1kJ/mol
2 CH3OH(g) = CH3OCH3(g)+H2O(g) △H3=-24.5kJ/mol
则反应2CO2(g)+6H2(g)= CH3OCH3(g)+3H2O(g) △H=________。
(2)二甲醚(CH3OCH3)燃料电池可以提升能量利用率。利用二甲醚酸性介质燃料电池电解200mL饱和食盐水(惰性电极),电解一段时间后,阴极收集到标况下的氢气2.24L(设电解后溶液体积不变)
①二甲醚燃料电池的正极反应式为_____________,负极反应式为___________。
②请写出电解食盐水的化学方程式_______________________。
③电解后溶液的pH=_________,理论上消耗二甲醚的质量为___________(保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2、NH4HSO4用途广泛。请回答下列问题:
(1)常温时,0.1 mol·L-1 NH4Al(SO4)2溶液的pH=3。则溶液中c(NH4+)+c(NH3·H2O)_______c (Al3+) + c[Al(OH)3](填“﹥”、“﹤”或“=”);2c(SO42-)- c(NH4+)-3c(Al3+)=________mol·L-1(填数值)。
(2)80℃时,0.1 mol·L-1 NH4Al(SO4)2溶液的pH小于3,分析导致pH随温度变化的原因是________________________ (用离子方程式并结合文字叙述回答)。
(3)常温时,向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加 0.1 mol·L-1 NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示。向NH4HSO4溶液中滴加NaOH溶液到a点的过程中,发生反应的离子方程式为__________________。
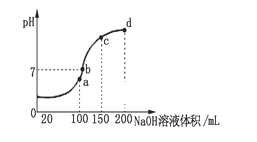
(4)常温时,浓度为0.1 mol·L-1Na HSO4溶液与pH=12的氢氧化钠溶液反应后混合液pH=2则二者体积比为_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,向1L密闭容器中加入2 mol N2和7molH2,发生反应N2+3H2![]() 2NH3,2分钟末时,测得剩余氮气为1mol,下列有关该反应的反应速率的描述中不正确的是()。
2NH3,2分钟末时,测得剩余氮气为1mol,下列有关该反应的反应速率的描述中不正确的是()。
A.υ(N2)= 0.5 mol/(L·min)B.υ(H2)= 1.5 mol/(L·min)
C.υ(NH3)= 1 mol/(L·min)D.υ(N2)=1mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂制备净水剂硫酸铁铵晶体![]() 的一种方案如下:
的一种方案如下:

下列说法不正确的是![]()
A.滤渣A的主要成分是![]()
B.“合成”反应要控制温,温度过高,产率会降低
C.“系列操作”包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥等
D.相同条件下,![]() 净水能力比
净水能力比![]() 强
强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,W在大气中有两种同素异形体且均能支持燃烧,X的原子半径是所有短周期主族元素中最大的,非金属元素Y的原子序数是Z的最外层电子数的2倍。下列叙述不正确的是( )
A.Y、Z的氢化物稳定性Y>Z
B.Y单质的熔点高于X单质
C.X、W、Z能形成具有强氧化性的XZW
D. 中W和Y都满足8电子稳定结构
中W和Y都满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在3种不同条件下,分别向容积为2L的恒容密闭容器中充入2molA和1molB,发生反应:2A(g)+B(g)![]() 2C(g) ΔH=QkJ/mol。相关条件和数据见下表:
2C(g) ΔH=QkJ/mol。相关条件和数据见下表:
实验编号 | 实验Ⅰ | 实验Ⅱ | 实验Ⅲ |
反应温度/℃ | 700 | 700 | 750 |
达平衡时间/min | 40 | 5 | 30 |
平衡时n(C)/mol | 1.5 | 1.5 | 1 |
化学平衡常数 | K1 | K2 | K3 |
下列说法正确的是( )
A.K1=K2<K3
B.升高温度能加快反应速率的原因是降低了反应的活化能
C.实验Ⅱ比实验Ⅰ达平衡所需时间小的可能原因是使用了催化剂
D.实验Ⅲ达平衡后,恒温下再向容器中通入1molA和1molC,平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是

A. 用石墨作阳极,铁作阴极
B. 阳极的电极反应式为:Cl- + 2OH--2e-= ClO- + H2O
C. 阴极的电极反应式为:2H2O + 2e- = H2↑ + 2OH-
D. 除去CN-的反应:2CN-+ 5ClO- + 2H+ = N2↑ + 2CO2↑ + 5Cl-+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1 mol·L-1的CH3COOH溶液滴定20 mL 0.1 mol·L-1的NaOH溶液,当滴加V mL CH3COOH溶液时,混合溶液的pH=7。已知CH3COOH的电离平衡常数为Ka,忽略混合时溶液体积的变化,下列关系式正确的是( )
A.Ka=![]() B.V=
B.V=![]() C.Ka=
C.Ka=![]() D.Ka=
D.Ka=![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com