
【题目】某化工厂制备净水剂硫酸铁铵晶体![]() 的一种方案如下:
的一种方案如下:

下列说法不正确的是![]()
A.滤渣A的主要成分是![]()
B.“合成”反应要控制温,温度过高,产率会降低
C.“系列操作”包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥等
D.相同条件下,![]() 净水能力比
净水能力比![]() 强
强
科目:高中化学 来源: 题型:
【题目】已知常温时CH3COOH的电离平衡常数为K。该温度下向20 mL 0.1 mol·L-1 CH3COOH溶液中逐滴加入0.1 mol·L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中错误的是( )
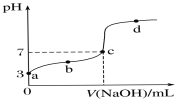
A.a点表示的溶液中c(H+)等于10-3 mol·L-1
B.b点表示的溶液中c(CH3COO-)>c(Na+)
C.c点表示CH3COOH和NaOH恰好反应完全
D.b、d点表示的溶液中![]() 均等于K
均等于K
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列各组离子在指定溶液中一定能大量共存的是
A.能使甲基橙变红的溶液中:K+、Mg2+、NO3-、I-
B.c(HCO3-)=1 mol·L-1溶液中:Na+、NH4+、SO42-、OH-
C.无色透明的溶液中: Fe3+、Al3+、NO3-、SO42-
D.![]() =1012的溶液中:Na+、Ba2+、Cl-、AlO2-
=1012的溶液中:Na+、Ba2+、Cl-、AlO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述中正确的是()

A. 断裂1 mol A—A和1 mol B—B键,放出a kJ能量
B. 每生成2 mol AB(g)吸收b kJ能量
C. 该反应中反应物的总能量高于生成物的总能量
D. 该反应热ΔH=(a-b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA 代表阿伏加德罗常数的值,下列叙述正确的是
A.常温常压下,1.8g 甲基(—CD3)中含有的中子数目为 NA
B.0.5mol 雄黄(As4S4,结构为![]() )含有 NA 个 S-S 键
)含有 NA 个 S-S 键
C.pH=1 的尿酸(HUr)溶液中,含有 0.1NA 个 H+
D.标准状况下,2.24 L 丙烷含有的共价键数目为 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素周期表的一部分,其中A、B、C、D、E代表元素。下列说法错误的是

A.元素B、D对应族①处的标识为ⅥA16
B.熔点:D的氧化物<C的氧化物
C.AE3分子中所有原子都满足8电子稳定结构
D.E的含氧酸酸性强于D的含氧酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知可逆反应:M(g)+N(g)P(g)+Q(g) ΔH>0,请回答下列问题:
①在某温度下,反应物的起始浓度分别为c(M)=1 mol·L-1,c(N)=2.4 mol·L-1;达到平衡后,M的转化率为60%,此时N的转化率为________。
②若反应温度不变,反应物的起始浓度分别为c(M)=4 mol·L-1,c(N)=a mol·L-1;达到平衡后,c(P)=2 mol·L-1,a=________。
③若反应温度不变,反应物的起始浓度为c(M)=c(N)=c(P)=c(Q)=2mol·L-1,此时v(正)_________v(逆)(填“>”、“<”或“=”)
(2)合成氨工业对国民经济和社会发展具有重要的意义。其原理为:N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:
①根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越___。
②对于合成氨反应而言,下列有关图象一定正确的是(选填序号)_______。

③相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1 mol N2和3 mol H2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;B中NH3的体积分数为b,放出热量Q2 kJ。则:b ________ a (填“>”、“=”或“<”,下同),Q1________Q2,Q1________92.4。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有室温下四种溶液,下列有关叙述不正确的是( )

A. ③和④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B. ②和③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C. 分别加水稀释10倍,四种溶液的pH:①>②>④>③
D. V1L ④与V2L ①溶液混合后,若混合后溶液pH=7,则V1<V2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
A.放电时负极反应为Zn-2e-+2OH-===Zn(OH)2
B.充电时阳极反应为Fe(OH)3-3e-+5OH-===![]() +4H2O
+4H2O
C.放电时每转移3 mol电子,正极有1 mol K2FeO4被还原
D.放电时正极附近溶液的酸性增强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com