
【题目】(1)已知可逆反应:M(g)+N(g)P(g)+Q(g) ΔH>0,请回答下列问题:
①在某温度下,反应物的起始浓度分别为c(M)=1 mol·L-1,c(N)=2.4 mol·L-1;达到平衡后,M的转化率为60%,此时N的转化率为________。
②若反应温度不变,反应物的起始浓度分别为c(M)=4 mol·L-1,c(N)=a mol·L-1;达到平衡后,c(P)=2 mol·L-1,a=________。
③若反应温度不变,反应物的起始浓度为c(M)=c(N)=c(P)=c(Q)=2mol·L-1,此时v(正)_________v(逆)(填“>”、“<”或“=”)
(2)合成氨工业对国民经济和社会发展具有重要的意义。其原理为:N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:
①根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越___。
②对于合成氨反应而言,下列有关图象一定正确的是(选填序号)_______。

③相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1 mol N2和3 mol H2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;B中NH3的体积分数为b,放出热量Q2 kJ。则:b ________ a (填“>”、“=”或“<”,下同),Q1________Q2,Q1________92.4。
【答案】25% 6 < 小 a、c < < <
【解析】
(1)①根据M的转化率为60%计算出M的浓度变化量,利用浓度变化量之比等于化学计量数之比求出N的浓度变化量,再根据转化率定义计算;
②由于温度不变,则平衡常数不变,与(1)相同,利用三段式计算平衡时各组分的浓度,代入平衡常数计算.
③用浓度商Qc和平衡常数的相对大小,判断正逆反应速率的相对大小;
(2)①K为生成物浓度幂之积与反应物浓度幂之积的比②该反应为放热反应,升高温度,平衡逆向移动,则K减小;
②a.先出现拐点的先达到平衡,则T2大,温度高,平衡逆向移动,氨气的体积分数小;
b.平衡时浓度不一定相等,平衡只是浓度保持不变的状态;
c.使用催化剂加快反应速率,对平衡无影响;
③恒容密闭容器A,反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1kJ,
而恒压密闭容器B,均充入1mol N2和3molH2,反应发生后总物质的量减少,由pV=nRT可知,相对于A来说,相当于B加压,则平衡正向移动。
(1) ①△c(M)=60%×1molL1=0.6molL1,浓度变化量之比等于化学计量数之比,所以△c(N)=△c(M)=0.6molL1,故此时N的转化率![]() ×100%=25%,
×100%=25%,
故答案为:25%;
②△c(M)=60%×1molL1=0.6molL1,则:
M(g)+N(g)P(g)+Q(g)
初始(mol/L):1 2.4 0 0
转化(mol/L):0.6 0.6 0.6 0.6
平衡(mol/L):0.4 1.8 0.6 0.6
故该温度下平衡常数k=![]() =0.5,
=0.5,
反应温度不变,反应物的起始浓度分别为c(M)=4molL1,c(N)=amolL1;达到平衡后,c(P)=2molL1,则:
M(g)+N(g)P(g)+Q(g) ;
初始(mol/L):4 a 0 0
转化(mol/L):2 2 2 2
平衡(mol/L):2 a2 2 2
所以平衡常数K=![]() =0.5,解得a=6,
=0.5,解得a=6,
故答案为:6;
③Qc=![]() =
=![]() =1>K=0.5,反应逆向进行,因此v(正)<v(逆),
=1>K=0.5,反应逆向进行,因此v(正)<v(逆),
(2)①该反应为放热反应,升高温度,平衡逆向移动,则平衡常数K减小,温度越高,K越小,
故答案为:小;
②a.先出现拐点的先达到平衡,则T2大,温度高,平衡逆向移动,与图象一致,故a正确;
b.平衡时浓度不一定相等,平衡浓度取决起始浓度和转化率,图象表示错误,故b错误;
c.使用催化剂加快反应速率,对平衡无影响,平衡时物质的浓度不变,与图象一致,故c正确;
故答案为:ac;
③恒容密闭容器A,反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1kJ,而恒压密闭容器B,均充入1mol N2和3molH2,反应发生后总物质的量减少,由pV=nRT可知,相对于A来说,相当于B加压,则平衡正向移动,氨气的体积分数变大,所以a<b,B中放出的热量对,则Q1<Q2,热化学方程式中反应热为完全反应放出的热量,而A中不能完全转化,放出的热量少,则Q1<92.4,
故答案为:<;<;<。


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案科目:高中化学 来源: 题型:
【题目】(1)配制500mL 3.6mol/L 的稀H2SO4所需18 mol/L的浓H2SO4的体积为________mL。
(2)常温下,将0.1 mol/L的NH4Cl溶液与0.1 mol/L的氨水溶液等体积混合,所得混合液的pH=7,则c(NH4+)=________mol/L,c(Cl-)=________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)葡萄酒中SO2最大使用量为0.25 g·L-1,取300.00 mL葡萄酒,通过适当的方法使所含SO2全部逸出并用H2O2将其全部氧化为H2SO4,然后用0.090 0 mol·L-1NaOH标准溶液进行滴定。
①写出上述氧化还原反应的化学方程式:___________________
②若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积________(填序号)。
A.=10 mL B.=40 mL C. <10 mL D. >40 mL。
③若滴定终点时PH=8.8,可选择_______为指示剂
④滴定终点读数时俯视刻度线,则测量结果比实际值________(填“偏高”、“偏低”或“无影响”)。
(2)某学生用0.100molL-1的KOH标准溶液滴定未知浓度的盐酸,其操作为:
A.移取20mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴处充满溶液;
D.取标准KOH溶液注入碱式滴定管至刻度“0”以上2~3cm 处;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管下面,用标准KOH溶液滴定至终点并记下刻度。
实验编号 | KOH溶液的浓度(mol/L) | 滴定完成时,KOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
①正确操作步骤的顺序是(用序号字母填写)__________________________
②根据上述数据,可计算出该盐酸的浓度约为______________(保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂制备净水剂硫酸铁铵晶体![]() 的一种方案如下:
的一种方案如下:

下列说法不正确的是![]()
A.滤渣A的主要成分是![]()
B.“合成”反应要控制温,温度过高,产率会降低
C.“系列操作”包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥等
D.相同条件下,![]() 净水能力比
净水能力比![]() 强
强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、M 为原子序数依次増加的五种短周期元素,A、B、C、D、E 是由这些元素组成的常见化合物,A、B 为厨房中的食用碱,C 是一种无色无味的气体,C、D 都是只有两种元素组成。上述物质之间的转化关系为: ![]() (部分反应物戒生成物省略)。下列说法错误的是
(部分反应物戒生成物省略)。下列说法错误的是
A.原子半径大小序,W>Y>Z>X
B.对应最简单氢化物的沸点:Z>M
C.上述变化过秳中,发生的均为非氧化还原反应
D.Z 和 W 形成的化合物中一定只含离子健
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在3种不同条件下,分别向容积为2L的恒容密闭容器中充入2molA和1molB,发生反应:2A(g)+B(g)![]() 2C(g) ΔH=QkJ/mol。相关条件和数据见下表:
2C(g) ΔH=QkJ/mol。相关条件和数据见下表:
实验编号 | 实验Ⅰ | 实验Ⅱ | 实验Ⅲ |
反应温度/℃ | 700 | 700 | 750 |
达平衡时间/min | 40 | 5 | 30 |
平衡时n(C)/mol | 1.5 | 1.5 | 1 |
化学平衡常数 | K1 | K2 | K3 |
下列说法正确的是( )
A.K1=K2<K3
B.升高温度能加快反应速率的原因是降低了反应的活化能
C.实验Ⅱ比实验Ⅰ达平衡所需时间小的可能原因是使用了催化剂
D.实验Ⅲ达平衡后,恒温下再向容器中通入1molA和1molC,平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学用语是学习化学的重要工具,下列表示物质变化的化学用语中正确的是( )
A. 汽车用的铅蓄电池充电时阳极反应:PbSO4+2H2O-2e-=PbSO4+4H++SO42-
B. 利用Na2CO3溶液可除油污:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
C. BaSO4的水溶液导电性极弱: BaSO4![]() Ba2++SO42-
Ba2++SO42-
D. 用醋酸除去暖瓶中的水垢:2H++ CaCO3=Ca2++CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝硅合金材料性能优良。铝土矿(含 30% SiO2、40.8% Al2O3和少量Fe2O3等)干法制取该合金的工艺如下:
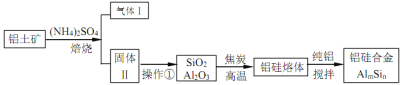
(1)铝硅合金材料中若含铁,会影响其抗腐蚀性。原因是______________。
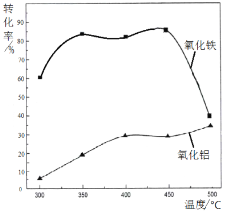
(2)焙烧除铁反应时 Fe2O3 转化为NH4Fe(SO4)2,Al2O3少部分发生类似反应。写出 Fe2O3发生反应的方程式:______________。 氧化物转化为硫酸盐的百分率与温度的关系如图,最适宜焙烧温度为______________。
(3)若操作①中所得溶液中加入过量NaOH 溶液,含铝微粒发生反应的离子方程式为:______________。
(4)用焦炭还原SiO2、Al2O3会产生SiC等中间体。写出中间体 SiC 再与Al2O3反应生成铝、硅单质的化学方程式并表出电子转移的方向和数目:______________ 。
(5)已知25℃时Ksp[Al(OH)3]=1.0×10-33,Ksp[Fe(OH)3]=4.0×10-38。向 FeCl3和 AlCl3的混合溶液中逐滴加入NaOH 溶液,生成 Al(OH)3和Fe(OH)3沉淀,当两种沉淀共存时,上层溶液中 c(Al3+):c(Fe3+)=__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应速率的理解正确的是( )
A.化学反应速率是指单位时间内任一种反应物浓度的减少或生成物浓度的增加
B.化学反应速率是指某一时刻,某种反应物的瞬时速率
C.根据化学反应速率的大小可以知道化学反应进行的快慢
D.对于任何化学反应来说,反应速率越大,反应现象越明显
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com