
����Ŀ��X��Y��Z��W��M Ϊԭ���������Ή��ӵ����ֶ�����Ԫ�أ�A��B��C��D��E ������ЩԪ����ɵij��������A��B Ϊ�����е�ʳ�üC ��һ����ɫ��ζ�����壬C��D ����ֻ������Ԫ����ɡ���������֮���ת����ϵΪ: ![]() (���ַ�Ӧ���������ʡ��)������˵���������
(���ַ�Ӧ���������ʡ��)������˵���������
A.ԭ�Ӱ뾶��С��W��Y��Z��X
B.��Ӧ����⻯��ķе�:Z��M
C.�����仯�����У������ľ�Ϊ��������ԭ��Ӧ
D.Z �� W �γɵĻ�������һ��ֻ�����ӽ�

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijNa2CO3��Ʒ�к���KCl��NaCl���ʡ�������֪����31.5%������27.08%(���Ͼ�Ϊ��������)����Ʒ�к�Na2CO3����������Ϊ(����)
A.25%
B.50%
C.80%
D.��ȷ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��800��ʱ�����淴Ӧ CO��g��+H2O��g��CO2��g��+H2��g����ƽ�ⳣ�� K=1��800��ʱ�����ijһʱ���ܱ������и���ֵ�Ũ�����������˵����ȷ���ǣ�������
���� | CO | H2O | CO2 | H2 |
Ũ��/molL-1 | 0.002 | 0.003 | 0.0025 | 0.0025 |
A.��ʱƽ�������ƶ�
B.�ﵽƽ�������ѹǿ����
C.�����������ݻ�ѹ��Ϊԭ����һ�룬ƽ����ܻ��������ƶ�
D.����Ӧ������С������ʱ���ﵽ��ѧƽ��״̬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA ���������ӵ�������ֵ������������ȷ����
A.���³�ѹ�£�1.8g ��(��CD3)�к��е�������ĿΪ NA
B.0.5mol �ۻ�(As4S4���ṹΪ![]() )���� NA �� S-S ��
)���� NA �� S-S ��
C.pH��1 ������(HUr)��Һ�У����� 0.1NA �� H+
D.��״���£�2.24 L ���麬�еĹ��ۼ���ĿΪ NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ��ǿ������PbO2���Ʊ�KClO4�Ĺ�ҵ�������£�
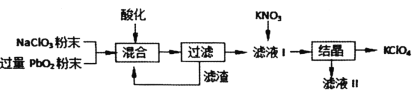
���������Ʋ⣬�����жϲ���ȷ����( )
A.���ữ�����Լ���ϡ�����Ũ����
B.����������Ҫ�ɷ���PbO2��ĩ����ѭ��ʹ��
C.NaClO3��PbO2��Ӧ�����ӷ���ʽΪ![]()
D.��KNO3��KClO4��NaClO4��NaNO3�У��������ܽ��С����KClO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����֪���淴Ӧ��M(g)��N(g)P(g)��Q(g) ��H��0����ش��������⣺
����ij�¶��£���Ӧ�����ʼŨ�ȷֱ�Ϊc(M)��1 mol��L��1��c(N)��2.4 mol��L��1���ﵽƽ���M��ת����Ϊ60%����ʱN��ת����Ϊ________��
������Ӧ�¶Ȳ��䣬��Ӧ�����ʼŨ�ȷֱ�Ϊc(M)��4 mol��L��1��c(N)��a mol��L��1���ﵽƽ���c(P)��2 mol��L��1��a��________��
������Ӧ�¶Ȳ��䣬��Ӧ�����ʼŨ��Ϊc(M)��c(N)��c(P)��c(Q)��2mol��L��1����ʱv(��)_________v(��)��������������<������=����
��2���ϳɰ���ҵ�Թ��ú���ᷢչ������Ҫ�����塣��ԭ��Ϊ��N2(g)��3H2(g)2NH3(g)����H����92.4 kJ/mol���ݴ˻ش��������⣺
�ٸ����¶ȶԻ�ѧƽ���Ӱ����ɿ�֪�����ڸ÷�Ӧ���¶�Խ�ߣ���ƽ�ⳣ����ֵԽ___��
�ڶ��ںϳɰ���Ӧ���ԣ������й�ͼ��һ����ȷ����(ѡ�����)_______��

����ͬ�¶��£��к����ܱ�����A�ͺ�ѹ�ܱ�����B���������о�����1 mol N2��3 mol H2����ʱ�������������ȡ���һ�������·�Ӧ�ﵽƽ��״̬��A��NH3���������Ϊa���ų�����Q1 kJ��B��NH3���������Ϊb���ų�����Q2 kJ����b ________ a (����>��������������<������ͬ)��Q1________Q2��Q1________92.4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪԪ�����ڱ���һ���֣�����Ԫ��a~j�����ڱ��е�λ�ã���Ҫ��ش��������⡣
�� ���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
1 | a | |||||||
2 | b | c | d | e | ||||
3 | f | g | h | i | j | |||
��1��f��g��h�ĵ��ʷֱ���ˮ��Ӧ������ҵ���___________����Ԫ�ط��ţ���
��2��c��i���⻯���ȶ��Խ�ǿ����____________���ѧʽ����
��3��c��f���γɼȺ����Ӽ��ֺ��Ǽ��Լ��Ļ�����û�����ĵ���ʽΪ__________��
��4��d��f��g�����Ӱ뾶������_______________�������ӷ��ţ���
��5��f������������ˮ������h������������ˮ���ﷴӦ�����ӷ���ʽΪ��_______
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ����Ƴ�����ĤH2Sȼ�ϵ�أ�ʵ��������H2S������Դ�����������õ�����������ĤH2Sȼ�ϵ�صĽṹʾ��ͼ����ͼ��ʾ������˵������ȷ����

A. �缫aΪ��صĸ���
B. �缫b�Ϸ����ĵ缫��ӦΪ��O2 +4H+ + 4e��=== 2H2O
C. ��·��ÿ����4 mol���ӣ�����������44.8 LH2S
D. ÿ17 g H2S���뷴Ӧ����1 mol H+������Ĥ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ˮ��Һ�д��ڵ���ƽ�⡢ˮ��ƽ�⡢�ܽ�ƽ�⣬��ش��������⡣
(1)��֪��������ĵ��볣�����±���
���� | HCOOH | HCN | H2CO3 |
���볣��(25 ��) | Ka��1.77��10��4 | Ka��5.0��10��10 | Ka1��4.3��10��7 Ka2��5.6��10��11 |
��HCOONa��NaCN��NaHCO3��Na2CO3��4����Һ�������ӽ������������ǿ����__________��
�������ͬ��c(H��)��ͬ����������Һa.HCOOH��b.HCN��c.H2SO4�ֱ���ͬŨ�ȵ�NaOH��Һ��ȫ�кͣ�����NaOH��Һ������ɴ�С������˳����(����ĸ) ___________��
����NaCN��Һͨ������CO2��Ӧ�Ļ�ѧ����ʽ��_____________________________��
(2)��һ��Ũ�ȵ�NaCN��ҺpH��9�������ӷ���ʽ��ʾ�ʼ��Ե�ԭ����____________����ʱc(HCN)/c(CN��)��____________��
�������£�NaCN�����������Һ��Ӧ������NaHCO3����ʹʪ��ĺ�ɫʯ����ֽ����ɫ�����壬����䶾�ԡ��÷�Ӧ�Ļ�ѧ����ʽ��___________________________��
(3)��֪CaCO3��Ksp��2.8��10��9���ֽ�Ũ��Ϊ2��10��4 mol��L��1 Na2CO3��Һ��CaCl2��Һ�������ϣ�������CaCO3��������CaCl2��Һ����СŨ��Ϊ_____________mol��L��1��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com