
【题目】甲醇是有机化工原料和优质燃料,主要应用于精细化工、塑料等领域,也是农药、医药的重要原料之一。
(1)已知反应CO(g)+2H2(g)== CH3OH(g) H= —99kJ.mol—1中的相关化学键键能如下:
化学键 | H-H | C-O | C≡O | H-O | C-H |
E/(kJ.mol-1) | 436 | 343 | x | 465 | 413 |
则x=___________________。
(2)在一容积可变的密闭容器中,1molCO与2molH2发生反应:CO(g)+2H2(g)![]() CH3OH(g) ,
CH3OH(g) ,
CO在不同温度下的平衡转化率(α)与压强的关系如图所示。
①a、b两点的反应速率:v(b)____v(a)(填“>”、“<”或“=”)。②该反应的△S______0,图中的T1______T2(填“>”、“<”或“=”)。
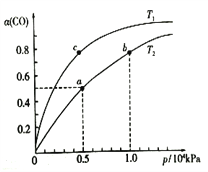
③该合成反应的温度一般控制在240~270℃,选择此温度范围的原因是:
I.此温度范围下的催化剂活性高;
II.______________________________________________________。
④图中a点的压强平衡常数KP=_______________(KPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)利用合成气(主要成分为CO和H2)合成甲醇,发生主要反应如下:
I:CO(g)+2H2(g)![]() CH3OH(g) H1
CH3OH(g) H1
II:CO2(g)+H2(g) ![]() CO(g) + H2O(g) H2
CO(g) + H2O(g) H2
III:CO2(g)+3H2(g)![]() CH3OH(g) + H2O(g) H3
CH3OH(g) + H2O(g) H3
上述反应对应的平衡常数分别为K1、K2、K3,它们随温度变化曲线如下图所示。
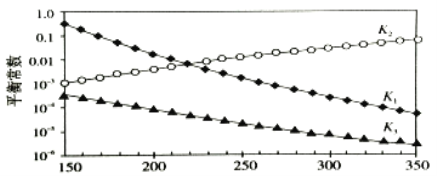
则H1___________H3(填“>”、“<”或“=”), 理由是__________________________。
【答案】 1076 > < < 温度低于240℃,反应速率太慢;同时该反应为放热反应,温度高于270℃,化学平衡逆向移动,转化率降低(其他合理答案均可) 1.6×10-7 < 由图可知,随着温度升高,K2减小,则△H2>0,根据盖斯定律又得△H3=△H1+△H2,所以△H1<△H3
【解析】(1)反应热=反应物的总键能-生成物的总键能,则△H=2×436+x-343-413×3-465=-99,解得x=1076;故答案为:1076;
(2)①压强越大反应速率越快,所以a、b两点的反应速率:v(b)>v(a);故答案为:>;
②CO(g)+2H2(g) ![]() CH3OH(g) H= —99kJ·mol—1,反应中气体的物质的量减少,△S<0,该反应是放热反应,温度升高,平衡逆向移动,CO的平衡转化率减小,故Tl<T2;故答案为:<;<;
CH3OH(g) H= —99kJ·mol—1,反应中气体的物质的量减少,△S<0,该反应是放热反应,温度升高,平衡逆向移动,CO的平衡转化率减小,故Tl<T2;故答案为:<;<;
③该合成反应的温度一般控制在240~270℃,选择此温度范围的原因有此温度范围下的催化剂活性高;温度低于240℃,反应速率太慢;同时该反应为放热反应,温度高于270℃,化学平衡逆向移动,转化率降低,故答案为:温度低于240℃,反应速率太慢;同时该反应为放热反应,温度高于270℃,化学平衡逆向移动,转化率降低;
④a点的一氧化碳转化率为50%,总压为0.5MPa,
CO(g)+2H2(g)CH3OH(g)
起始量(mol)1 2 0
变化量(mol)x 2x x
平衡量(mol)1-x 2-2x x
而一氧化碳转化率为50%,所以x=0.5mol,Kp=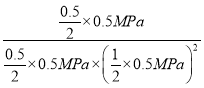 =1.6×10-7;故答案为:1.6×10-7;
=1.6×10-7;故答案为:1.6×10-7;
(3)由图可知,随着温度升高,K2减小,则△H2>0,根据盖斯定律又得△H3=△H1+△H2,所以△H1<△H3;故答案为:<;由图可知,随着温度升高,K2减小,则△H2>0,根据盖斯定律又得△H3=△H1+△H2,所以△H1<△H3。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】实验室探究SO2与Fe(NO3)3溶液反应的原理,装置如下图,实验中Y装置产生白色沉淀。下列说法不正确的是

A. 滴加浓硫酸之前应进行的操作是打开弹簧夹,通入一段时间N2
B. Y中产生的白色沉淀是BaSO4或BaSO3
C. 产生白色沉淀的原因可能是在酸性条件下SO2与NO3- 反应生成了SO42-
D. 若将Fe(NO3)3换成FeCl3,Y中也能产生白色沉淀,说明Fe3+也能将SO2氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子中,在酸性溶液中能大量共存,且溶液为无色透明的是( )
A.K +、.MnO 4﹣、Cl ﹣、SO 42﹣
B.Na +、CO 32﹣、Cl ﹣、SO 42﹣
C.NO 3﹣、Na +、HCO 3﹣、Ba 2+
D.Na +、NO 3﹣、NH 4+、SO 42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近,全国的雾霾天气对环境造成了严重影响,芜湖市开展了和臭氧的监测。 下列有关说法正确的是
A. 臭氧的摩尔质量是 48g
B. 同温同压条件下,等质量的氧气和臭氧体积比为 2:3
C. 20g 氖气中含有个 6.02 × 1023 个原子
D. 1.00mol 臭氧中含有电子总数为 18 × 6.02 × 1023个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应中属于阴影部分的是( )
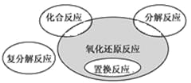
A. CuSO4 + Mg = Cu + MgSO4
B. 4NH3 + 5O2 = 4NO + 6H2O
C. 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
D. 2NaHCO3 =Na2CO3 + H2O + CO2 ↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 丙烯中所有原了共平面
B. 葡萄糖、花生油和蚕丝一定条件下都能发生水解反应
C. 乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去
D. C4H4仅有 和CH≡C-CH=CH2两种同分异构体
和CH≡C-CH=CH2两种同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O反应中氧化剂与还原剂物质的量之比为( )
A.1:8
B.8:1
C.1:5
D.5:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2可用作红酒的防腐剂,下列关于SO2的叙述不正确的是
A.能使酸性KMnO4溶液褪色B.能使品红溶液褪色
C.能与NaOH溶液反应D.能与水反应生成硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,只能表示一个化学反应的是( )
①Ag++Cl-===AgCl↓
②Ba2++2OH-+2H++SO![]() ===BaSO4↓+2H2O
===BaSO4↓+2H2O
③CO![]() +2H+===CO2↑+H2O
+2H+===CO2↑+H2O
④Fe+Cu2+===Fe2++Cu
A.①③ B.②④ C.②③ D.没有
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com