
【题目】氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应中属于阴影部分的是( )
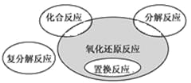
A. CuSO4 + Mg = Cu + MgSO4
B. 4NH3 + 5O2 = 4NO + 6H2O
C. 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
D. 2NaHCO3 =Na2CO3 + H2O + CO2 ↑
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
【题目】下列实验能达到预期目的的是
序号 | 实验内容 | 实验目的 |
A | 将FeCl3固体溶于少量浓盐酸中,再加蒸馏水稀释至所需浓度 | 配制氯化铁溶液 |
B | 常温下,将干电池的温度升高到40℃,其输出电流增大 | 证明干电池可将环境热能转化为电能 |
C | 向CuCl2溶液中加入NaOH调节pH>4 | 除去CuCl2的Fe3+杂质 |
D | 向BaSO4悬浊液中加入Na2CO3饱和溶液,过滤出的沉淀加入盐酸有气体生成 | 证明Ksp(BaCO3)<Ksp(BaSO4) |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某次实验需用0.4molL﹣1 NaOH溶液480mL.配制方法如下:
(1)配制该溶液所需的仪器有:量筒、天平、药匙、烧杯、玻璃棒、___、_____;
(2)用托盘天平准确称量___________g 固体NaOH;
(3)若在配制过程中出现下列情况,将使所配制的NaOH溶液的浓度偏高的是_________,对实验结果没有影响的是_____________(填各选项的序号).
A.所用的NaOH中混有少量Na2O
B.用托盘天平称量一定质量固体NaOH时,所用的小烧杯内壁不太干燥
C.配制溶液所用的容量瓶洗净后没有烘干
D.固体NaOH在烧杯中溶解后,立即将溶液转移到容量瓶内并接着进行后续操作
E.转移溶液后,未洗涤烧杯和玻璃棒就直接定容
F.最后确定NaOH溶液体积(定容)时,仰视容量瓶刻度线
G.定容摇匀后静止,发现液面低于刻度线,再加蒸馏水至刻度线.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锌被广泛应用于医药领域和工农业生产。工业上由氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)生产ZnSO47H2O的一种流程如图:

(1)步骤Ⅰ的操作是____________。
(2)步骤Ⅰ加入稀硫酸进行酸浸时,需不断通入高温水蒸气的目的是______________。
(3)步骤Ⅱ中,在pH约为5.1的滤液中加入高锰酸钾,生成Fe(OH)3和MnO(OH)2两种沉淀,该反应的离子方程式为____________________________________________。
(4)步骤Ⅲ中,加入锌粉的作用是______________。
(5)已知硫酸锌的溶解度与温度之间的关系如下表:
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度/g | 41.8 | 54.1 | 70.4 | 74.8 | 67.2 | 60.5 |
从硫酸锌溶液中获得硫酸锌晶体的实验操作为________________、冷却结晶、过滤。烘干操作需在减压低温条件下进行,原因是_________________________________。
(6)取28.70 g ZnSO47H2O加热至不同温度,剩余固体的质量变化如图所示。分析数据,680℃时所得固体的化学式为______。

a.ZnO b.Zn3O(SO4)2 c.ZnSO4 d.ZnSO4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是有机化工原料和优质燃料,主要应用于精细化工、塑料等领域,也是农药、医药的重要原料之一。
(1)已知反应CO(g)+2H2(g)== CH3OH(g) H= —99kJ.mol—1中的相关化学键键能如下:
化学键 | H-H | C-O | C≡O | H-O | C-H |
E/(kJ.mol-1) | 436 | 343 | x | 465 | 413 |
则x=___________________。
(2)在一容积可变的密闭容器中,1molCO与2molH2发生反应:CO(g)+2H2(g)![]() CH3OH(g) ,
CH3OH(g) ,
CO在不同温度下的平衡转化率(α)与压强的关系如图所示。
①a、b两点的反应速率:v(b)____v(a)(填“>”、“<”或“=”)。②该反应的△S______0,图中的T1______T2(填“>”、“<”或“=”)。
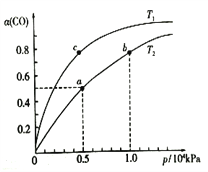
③该合成反应的温度一般控制在240~270℃,选择此温度范围的原因是:
I.此温度范围下的催化剂活性高;
II.______________________________________________________。
④图中a点的压强平衡常数KP=_______________(KPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)利用合成气(主要成分为CO和H2)合成甲醇,发生主要反应如下:
I:CO(g)+2H2(g)![]() CH3OH(g) H1
CH3OH(g) H1
II:CO2(g)+H2(g) ![]() CO(g) + H2O(g) H2
CO(g) + H2O(g) H2
III:CO2(g)+3H2(g)![]() CH3OH(g) + H2O(g) H3
CH3OH(g) + H2O(g) H3
上述反应对应的平衡常数分别为K1、K2、K3,它们随温度变化曲线如下图所示。
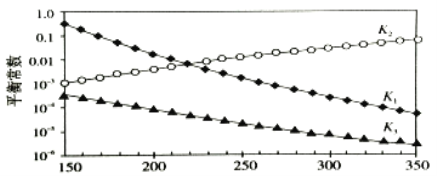
则H1___________H3(填“>”、“<”或“=”), 理由是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图所示装置进行实验,并回答下列问题。
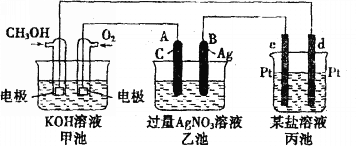
(1)甲池是_________池,通入CH3OH(甲醇)的电极作为_______极,电极反应式为________________________________________________。
(2)乙池是________池,A电极名称为______极,电极反应式为_______________________,乙池中的总反应化学方程式为________________________________,溶液的pH________(填“增大”、“减小”或“不变”)。
(3)当甲池中消耗O2 0.56L(标准状况下)时,理论上乙池中B极的质量增加_______g;此时丙装置中_____________(填“c”或“d”)电极析出1.20g金属,则丙装置中的某盐溶液可能是________(填序号)。
a.MgSO4溶液 b.CuSO4溶液 c.NaCl溶液 d.AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用水钴矿[主要成分为Co2O3和Co(OH)3,还含少量Fe2O3、Al2O3、MnO等]制取CoCl2·6H2O的工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)提高水钴矿浸出速率的措施有_______________________________________(填写两点),浸出过程中Co2O3发生反应的离子方程式为________________________。
(2)NaClO3的作用是_________________________________。
(3)加Na2CO3调pH至5.2所得沉淀为_________________。
(4)萃取剂对金属离子的萃取率与pH的关系如图。萃取剂的作用是___________________________________________;其使用的适宜pH范围是______________。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5

(5)由萃取后余液获得粗产品的操作步骤为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①R—NO2![]() R—NH2;71~50)下
R—NH2;71~50)下
②![]() +H2O;
+H2O;
③苯环上原有的取代基对新导入的取代基进入苯环的位置有显著影响。以下是用苯为原料制备某些化合物的转化关系图:
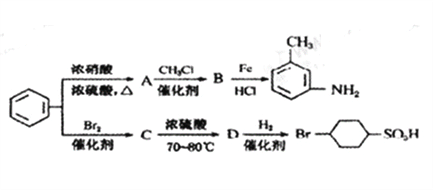
(1)A转化为B的化学方程式是_________________________。
(2)在“![]() ”的所有反应中属于取代反应的是_______(填字母),属于加成反应的是__________(填字母)。
”的所有反应中属于取代反应的是_______(填字母),属于加成反应的是__________(填字母)。
(3)B中苯环上的二氯代物有____种同分异构体。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com