
【题目】氮和硫的化合物在科研、生活及化学工业中具有重要的应用。
(1)已知:SO2(g)+1/2O2(g)=SO3(g) H=-99kJ·mol-1
SO2(g)+NO2(g)=SO3(g)+ NO(g) H=-41.8kJ·mol-1
CO(g)+1/2O2(g)=CO2(g) H=-283kJ·mol-1
请写出CO和NO2反应生成CO2和NO的热化学反应方程式_________________,1molCO和1molNO2反应生成CO2和NO的能量反应示意图中的E2=_______kJ·mol-1

(2)可通过反应2CO(g)+SO2(g)![]() 2CO2(g)+S(l)来消除锅炉烟道气中的有毒气体,某温度下向密闭容器中通入一定量的SO2和CO气体发生反应,5分钟后达平衡,生成0.5 mol/L的CO2。
2CO2(g)+S(l)来消除锅炉烟道气中的有毒气体,某温度下向密闭容器中通入一定量的SO2和CO气体发生反应,5分钟后达平衡,生成0.5 mol/L的CO2。
①反应开始至平衡时,SO2的平均反应速率v(SO2)=________;
②其他条件不变时,SO2的平衡转化率随反应温度变化如图,请用简洁文字解释原因_________________________________________;

(3)25℃,在0.10 molL1H2S溶液中,溶液pH与c(S2)关系如下表(忽略溶液体积的变化、H2S的挥发),某溶液含0.020 molL1Mn2+、0.1 molL1H2S,当溶液的pH=5时,
Mn2+开始沉淀,则MnS的溶度积Ksp =________________;
pH | 3 | 5 | 7 | 9 | 11 |
c(S2-)/ molL1 | 1.4×1015 | 1.4×1011 | 6.8×108 | 1.3×105 | 1.3×103 |
(4)一种脱除废水中NH4+ 的电化学装置如图所示,请写出阳极的电极反应方程式:____________, 电解一段时间后阴极周围溶液的pH_____(填“增大”, “减小”或“不变”)。

【答案】 CO(g)+NO2(g)=CO2(g)+NO(g) H=-225.8kJ·mol-1 359.8 0.05mol/(L·min) 正反应为放热反应,温度升高平衡逆向移动,故二氧化硫平衡转化率降低;温度高于445℃后硫变成气态,正反应变为吸热反应,温度升高平衡正向移动,故二氧化硫平衡转化率升高。 Ksp(MnS)=2.8×10-13 Cl-+H2O-2e-=ClO-+2H+ 增大
【解析】(1)本题考查盖斯定律的应用,目标反应方程式为CO+NO2=CO2+NO,①SO2(g)+1/2O2(g)=SO3(g),② SO2(g)+NO2(g)=SO3(g)+ NO(g),③CO(g)+1/2O2(g)=CO2(g),②+③-①得出CO(g)+NO2(g)=CO2(g)+NO(g) △H=(-41.8-283+99)kJ·mol-1=-225.8kJ·mol-1,根据热化学反应方程式,E2=(134+225.8)kJ·mol-1=359.8kJ·mol-1;(2)考查化学反应速率的计算、影响化学平衡移动的因素,①生成CO2的浓度为0.5mol·L-1,因此消耗SO2的浓度为0.5/2mol·L-1=0.25 mol·L-1,根据化学反应速率的数学表达式,v(SO2)=0.25/5mol/(L·min)=0.05 mol/(L·min);②根据图像,0~445℃,随着温度的升高,SO2的转化率降低,说明正反应是放热反应,温度升高平衡逆向移动,故二氧化硫平衡转化率降低;445℃以后温度,硫变成气态,SO2的转化率随着温度的升高而升高,说明正反应变为吸热反应,温度升高平衡正向移动,故二氧化硫平衡转化率升高;(3)pH=5时,溶液中c(S2-)=1.4×10-11mol·L-1,根据Ksp=c(Mn2+)×c(S2-)=0.02×1.4×10-11=2.8×10-13;(4)考查电解原理和电极反应式的书写,根据电解原理,与电源正极相连的电极为阳极,阳极上失去电子,化合价升高,因此阳极电极反应式为Cl-+H2O-2e-=ClO-+2H+;根据电解示意图,阴极反应式为2H2O+2e-=H2↑+2OH-,生成OH-,溶液的pH增大。


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.实验室需要0.1 mol·L1NaOH溶液500 mL。根据溶液的配制情况回答下列问题。
(1)在下图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是__________________。

(2)配制时,其正确的操作顺序是__________(用字母表示,每个操作只用一次)。
A.用少量水洗涤烧杯2次~3次,洗涤液均注入容量瓶,振荡
B.在盛有NaOH固体的烧杯中加入适量水溶解
C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1 cm~2 cm处
(3)关于容量瓶的四种叙述:①是配制准确浓度溶液的仪器;②不宜贮存溶液;③不能用来加热;
④使用之前要检查是否漏水。这些叙述中正确的是__________(填字母)。
A.①②③④ B.②③ C.①②④ D.②③④
(4)根据计算用托盘天平称取的NaOH固体质量为______g。
Ⅱ.配制1 mol/L的稀硫酸溶液500 mL。回答下列问题。
(5)需要质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为_________mL(计算结果保留一位小数)。如果实验室有25 mL、50 mL、10 0mL量筒,应选用________mL规格的量筒最好。
(6)下面操作造成所配稀硫酸溶液浓度偏高的是______(填字母)。
A.溶解后溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视液面
D.用量筒量取浓硫酸后洗涤量筒并把洗涤液转移到容量瓶
E.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由化合物A 合成黄樟油(E)和香料F的路线如下(部分反应条件已略去):

请回答下列问题:
(l)下列有关说法正确的是______(填选项字母)。
a.化合物A 核磁共振氢谱为两组峰
b.CH2Br2只有一种结构
c.化合物E能发生加聚反应得到线型高分子
d.化合物B能发生银镜反应,也能与NaOH溶液反应
(2)由B转化为D所需的试剂为________。
(3)D含有的官能团名称为_______,C的同分异构体中具有顺反异构的是______(填名称,不必注明“顺”“反”)。
(4)写出A→B的化学反应方程式:_________。
(5)满足下列条件的E的同分异构体W有______种(不含立体异构),其中核磁共振氢谱为五组峰且峰面积之比是1:2:2:2:3的结构简式为________。
① lmolW与足量NaOH溶液反应,能消耗2molNaOH
② 能发生银镜反应
③ 苯环上只有两个取代苯,能发生聚合反应
(6)参照上述合成路线,写出以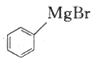 、
、 为主要原料(无机试剂任选),设计制备
为主要原料(无机试剂任选),设计制备 的合成路线:________________________。
的合成路线:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L密闭容器内,800 ℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表所示:
时间/(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)在第5 s时,NO的转化率为_________________________________。
(2)如图中表示NO2变化曲线的是______________________。
用O2表示0~2 s内该反应的平均速率v=______________________。

(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《天工开物》载:黄矾所出又奇甚,乃即炼皂矾炉侧土墙,刮取下来。染家用之,金色淡者涂炙,立成紫赤也。(皂矾FeSO4·7H2O;黄矾Fe2(SO4)3·10H2O;赤矾Fe2O3)下列有关说法正确的是
A. 皂矾可用于碱性花木土壤补铁
B. 皂矾变为黄矾是受热脱水过程
C. 黄矾受热分解可以获得赤矾
D. 矾是含结晶水的硫酸盐矿石
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式氧化镍(NiOOH)可用作镍氢电池的正极材料,可用废镍催化剂(主要含Ni、Al,少量Cr、FeS 等)来制备,其工艺流程如下:

回答下列问题:
(1)“浸泡除铝”时,发生反应的离子反应方程式为_________________________;
(2)“溶解”时放出的气体为_______________ (填化学式);
(3)已知该条件下金属离子开始沉淀和完全沉淀的pH如下表:
开始沉淀的pH | 完全沉淀的pH | |
Ni2+ | 6.2 | 8.6 |
Fe2+ | 7.6 | 9.1 |
Fe3+ | 2.3 | 3.3 |
Cr3+ | 4.5 | 5.6 |
“调pH 1”时,溶液pH范围为______________________;
(4)在空气中加热Ni(OH)2可得NiOOH,请写出此反应的化学方程式_____________;

(5)金属铬在溶液中有多种存在形式, CrO42—和Cr2O72—在溶液中可相互转化。室温下,初始浓度为1.0mol/L的Na2CrO4溶液中c(Cr2O72—)随c(H+)的变化如图所示,用离子方程式表示Na2CrO4溶液中的转化反应________________,根据A点数据计算出该转化反应的平衡常数为______________,温度升高,溶液中CrO42—的平衡转化率减小,则该反应的△H____0(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《茶疏》中对泡茶过程有如下记载:“治壶、投茶、出浴、淋壶、烫杯、酾茶、品茶……”。文中未涉及的操作方法是
A. 溶解 B. 萃取 C. 过滤 D. 蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器中,发生3A(g)+B(g)2C(g)的反应,若最初加入A和B都是4mol,A的平均反应速率为0.12molL﹣1s﹣1,则10s后容器中B的物质的量是( )
A. 1.6 mol B. 2.8 mol C. 3.2 mol D. 3.6 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com