
【题目】碱式氧化镍(NiOOH)可用作镍氢电池的正极材料,可用废镍催化剂(主要含Ni、Al,少量Cr、FeS 等)来制备,其工艺流程如下:

回答下列问题:
(1)“浸泡除铝”时,发生反应的离子反应方程式为_________________________;
(2)“溶解”时放出的气体为_______________ (填化学式);
(3)已知该条件下金属离子开始沉淀和完全沉淀的pH如下表:
开始沉淀的pH | 完全沉淀的pH | |
Ni2+ | 6.2 | 8.6 |
Fe2+ | 7.6 | 9.1 |
Fe3+ | 2.3 | 3.3 |
Cr3+ | 4.5 | 5.6 |
“调pH 1”时,溶液pH范围为______________________;
(4)在空气中加热Ni(OH)2可得NiOOH,请写出此反应的化学方程式_____________;

(5)金属铬在溶液中有多种存在形式, CrO42—和Cr2O72—在溶液中可相互转化。室温下,初始浓度为1.0mol/L的Na2CrO4溶液中c(Cr2O72—)随c(H+)的变化如图所示,用离子方程式表示Na2CrO4溶液中的转化反应________________,根据A点数据计算出该转化反应的平衡常数为______________,温度升高,溶液中CrO42—的平衡转化率减小,则该反应的△H____0(填“>”、“<”或“=”)。
【答案】 2Al+2OH-+2H2O==2AlO2-+3H2↑ H2、H2S 5.6~6.2 4Ni(OH)2+O2 == 4NiOOH+2H2O 2CrO42— + 2H+ ![]() Cr2O72— + H2O;(不写可逆符号不得分) K=c(Cr2O72—)/[ c2 (CrO42—)×c2 (H+)]=0.25/[0.52×(10—7) 2]=1014 <
Cr2O72— + H2O;(不写可逆符号不得分) K=c(Cr2O72—)/[ c2 (CrO42—)×c2 (H+)]=0.25/[0.52×(10—7) 2]=1014 <
【解析】本题考查化学工艺流程,(1)根据废镍中含有的成分,浸泡除铝过程中加入氢氧化钠,发生的离子反应方程式为2Al+2OH-+2H2O=2AlO2-+3H↑;(2)浸泡除铝后进行过滤,滤渣为Ni、Cr、FeS,加入稀硫酸溶解,Ni和Cr与稀硫酸反应生成H2,FeS与稀硫酸反应生成H2S,因此溶解过程中放出的气体为H2和H2S;(3)氧化1的目的是把Fe2+氧化成Fe3+,然后调节pH,根据整个流程图和表格数据,调节pH的范围是5.6~6.2;(4)Ni(OH)2中Ni显+2价,NiOOH中Ni显+3价,化合价升高,因此氧气参与反应,Ni(OH)2+O2→NiOOH,根据化合价的升降法进行配平,因此有4Ni(OH)2+O2 = 4NiOOH+2H2O ;(5)根据图像,Cr2O72-随着H+浓度的增大而增大,不能完全进行到底,因此此反应是可逆反应,离子反应方程式为2CrO42- + 2H+![]() Cr2O72- + H2O;根据平衡常数的定义,平衡常数的表达式为K=
Cr2O72- + H2O;根据平衡常数的定义,平衡常数的表达式为K=![]() =
=![]() =1014;升高温度,CrO42-的转化率降低,说明平衡向逆反应方向移动,正反应方向是放热反应,即△H<0;
=1014;升高温度,CrO42-的转化率降低,说明平衡向逆反应方向移动,正反应方向是放热反应,即△H<0;


科目:高中化学 来源: 题型:
【题目】下列关于乙烯(CH2==CH2)和环丙烷(CH2H2CCH2)比较的说法中,正确的是( )
A. 它们都为不饱和烃 B. 它们属于同系物
C. 互为同分异构体 D. 碳、氢元素的质量比相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用乙醛生产PTT(聚酯)和化合物M 的某种合成路线如下:

回答下列问题:
(1)A中官能团名称为______.
(2)B生成C的反应类型为_______。
(3)C的结构简式为_______,D化学名称是_______。
(4)由D生成PTT的化学方程式为____________________。
(5)芳香化合物W是M的同分异构体,它的溶液滴入FeCl3溶液显紫色,W共有______种(不含立体结构),其中核磁共振氢谱为四组峰的结构简式为_________。
(6)参照上述合成路线,以乙醇和1,3-丁二烯为原料(无机试剂任选),设计制备合成 路线___________________。
路线___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮和硫的化合物在科研、生活及化学工业中具有重要的应用。
(1)已知:SO2(g)+1/2O2(g)=SO3(g) H=-99kJ·mol-1
SO2(g)+NO2(g)=SO3(g)+ NO(g) H=-41.8kJ·mol-1
CO(g)+1/2O2(g)=CO2(g) H=-283kJ·mol-1
请写出CO和NO2反应生成CO2和NO的热化学反应方程式_________________,1molCO和1molNO2反应生成CO2和NO的能量反应示意图中的E2=_______kJ·mol-1

(2)可通过反应2CO(g)+SO2(g)![]() 2CO2(g)+S(l)来消除锅炉烟道气中的有毒气体,某温度下向密闭容器中通入一定量的SO2和CO气体发生反应,5分钟后达平衡,生成0.5 mol/L的CO2。
2CO2(g)+S(l)来消除锅炉烟道气中的有毒气体,某温度下向密闭容器中通入一定量的SO2和CO气体发生反应,5分钟后达平衡,生成0.5 mol/L的CO2。
①反应开始至平衡时,SO2的平均反应速率v(SO2)=________;
②其他条件不变时,SO2的平衡转化率随反应温度变化如图,请用简洁文字解释原因_________________________________________;

(3)25℃,在0.10 molL1H2S溶液中,溶液pH与c(S2)关系如下表(忽略溶液体积的变化、H2S的挥发),某溶液含0.020 molL1Mn2+、0.1 molL1H2S,当溶液的pH=5时,
Mn2+开始沉淀,则MnS的溶度积Ksp =________________;
pH | 3 | 5 | 7 | 9 | 11 |
c(S2-)/ molL1 | 1.4×1015 | 1.4×1011 | 6.8×108 | 1.3×105 | 1.3×103 |
(4)一种脱除废水中NH4+ 的电化学装置如图所示,请写出阳极的电极反应方程式:____________, 电解一段时间后阴极周围溶液的pH_____(填“增大”, “减小”或“不变”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,冰醋酸在加水稀释过程中溶液导电能力的变化曲线如图所示,请回答下列问题:

(1)O点导电能力为零的原因是_______________________________。
(2)a、b、c三点中,CH3COOH的电离度最大的是________;a、b、c三点的pH由小到大的顺序是___________CH3COOH的电离平衡常数表达式Ka=________。
(3)若使c点溶液中c(CH3COO-)增大,则下列措施中,可选择________(填字母序号)。
A.加热 B.加入很稀的NaOH溶液
C.加入固体KOH D.加水
E.加入固体CH3COONa F.加入锌粒
(4)在CH3COOH溶液的稀释过程中,始终保持增大趋势的是________(填字母序号)。
A.c(H+) B.H+的个数
C.CH3COOH的分子数 D.c(H+)/c(CH3COOH)
(5)下列有关CH3COOH溶液的说法正确的是________(填字母序号)。
A.CH3COOH溶液中各离子浓度的关系为c(H+)=c(OH-)+c(CH3COO-)
B.向0.10 mol/L的CH3COOH溶液中加水,c(H+)增大
C.CH3COOH溶液中各离子浓度的关系为c(CH3COO-)>c(H+)>c(OH-)
D.常温下,c(H+)=0.01 mol/L的CH3COOH溶液与c(OH-)=0.01 mol/L的NaOH溶液等体积混合后,溶液呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属(M)﹣空气电池(如图)具有原料易得,能量密度高等优点,有望成为新能源汽车和移动设备的电源,该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH)n,已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,下列说法不正确的是( )

A. 采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
B. 在Mg﹣空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
C. M﹣空气电池放电过程的正极反应式:正极反应式为O2+2H2O+4e﹣=4OH﹣
D. 比较Mg、Al、Zn三种金属﹣空气电池,Mg﹣空气电池的理论比能量最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸铁锂(LiFePO4)电池是一种高效、环保的新型电池,装置如图所示,其中正极材料橄榄石型LiFePO4通过粘合剂附着在铝箔表面,负极石墨材料附着在铜箔表面,电解质为溶解在有机溶剂中的锂盐,电池工作时的总反应为:LiFePO4+6C ![]() Li1-xFePO4+LixC6,则下列说法错误的是
Li1-xFePO4+LixC6,则下列说法错误的是
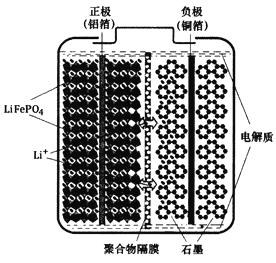
A. 装置中的聚合物隔膜应为阳离子交换膜
B. 充电时,Li+迁移方向为由右向左
C. 充电时,LiFePO4中的铁元素被氧化
D. 放电时,正极的电极反应式为:Li1-xFePO4+xLi++xe-=LiFePO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com