
【题目】化合物A(C4H10O)是一种有机溶剂,且A只有一种一氯取代物B,在一定条件下A可以发生如下变化:
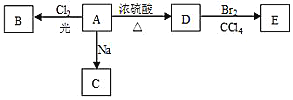
(1)A分子中的官能团名称是___,A的结构简式是___;
(2)写出下列化学方程式:
A→B:___;A→D:___;
(3)A的同分异构体F也可以有框图内A的各种变化,且F的一氯取代物有三种。F的结构简式是:___。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列表格中的各种情况,可以用对应选项中的图像表示的是
选项 | 反应 | 甲 | 乙 |
A | 外形、大小相近的金属和水反应 | Na | K |
B | 4mL0.01mol·L-1 KMnO4溶液分别和不同浓度的2mLH2C2O4(草酸)溶液反应 | 0.1mol·L-1的H2C2O4溶液 | 0.2mol·L-1的H2C2O4溶液 |
C | 5mL0.1mol·L-1Na2S2O3溶液和5mL0.1mol·L-1H2SO4溶液反应 | 热水 | 冷水 |
D | 5mL4%的过氧化氢溶液分解放出O2 | 无MnO2粉末 | 加MnO2粉末 |
A.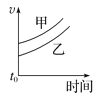 B.
B.
C. D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组探究潮湿的Cl2与Na2CO3反应的产物,进行如下实验根据设计要求回答:
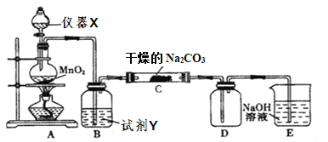
⑴X仪器名称是____________。
⑵装置A中发生反应的离子方程式:____________。
⑶B装置中试剂Y的作用是____________。
⑷下列有关该实验的说法中,不正确的是____________。
A.如图组装好实验仪器后,要先检查装置气密性,后添加药品
B.E装置的作用是吸收尾气防止污染空气
C.装置C中Cl2与Na2CO3以等物质的量反应,且生成的气体产物仅为Cl2O,可知反应方程式为2Cl2+2Na2CO3+H2O=2NaHCO3+2NaCl+Cl2O↑
D.试剂Y是浓硫酸,目的是干燥氯气
⑸设计实验方案验证C中生成的固体中存在![]() ____________。
____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用氯气生产某些含氯有机物时会产生副产物氯化氢。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2![]() 2Cl2+2H2O
2Cl2+2H2O
已知:①反应A中,4 mol氯化氢被氧化,放出115.6 kJ的热量。
②
(1)断开1 mol H—O 键与断开 1 mol H—Cl 键所需能量相差约为________kJ,
(2)水分子中H—O键比氯化氢分子中H—Cl键(填“强”或“弱”)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用如图所示做水果电池的实验,测得数据如下表所示:
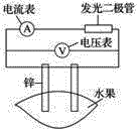
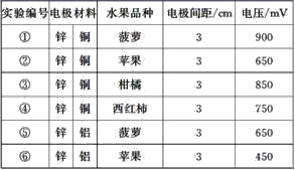
请回答以下问题:
(1)实验⑥中负极的电极反应式为_____________。
(2)实验①、⑤中电流方向相反的原因是_________。
(3)影响水果电池电压的因素有________、________。
(4)若在实验中发光二极管不亮,该同学用铜、锌作电极,用菠萝作介质,并将多个此电池串联起来,再接发光二极管,这样做________(填“合理”或“不合理”) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的接触室(见右图)。下列说法错误的是
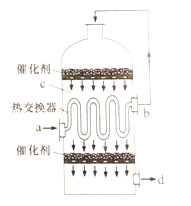
A. a、b两处的混合气体成分含量相同,温度不同
B. c、d两处的混合气体成分含量相同,温度不同
C. 热交换器的作用是预热待反应的气体,冷却反应后的气体
D. c处气体经热交换后再次催化氧化的目的是提高SO2的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.05mol·L-1的某稀酸H2B溶液中滴入0.1mol·L-1氨水,溶液中由水电离出氢离子浓度随滴入氨水体积变化如图。下列分析正确的是( )

A. NaHB溶液可能为酸性,也可能为碱性
B. A、B、C三点溶液的pH是逐渐减小,D、E、F三点溶液的pH是逐渐增大
C. E溶液中离子浓度大小关系:c(NH4+)>c(B2-)>c(OH-)>c(H+)
D. F点溶液c(NH4+)=2c(B2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是主要的温室气体,也是一种工业原料。回收利用CO2有利于缓解温室效应带来的环境问题。
(1)我国科学家通过采用一种新型复合催化剂,成功实现了CO2直接加氢制取高辛烷值汽油。
已知:2H2 (g)+O2 (g) =2H2O(l) ΔH = -571.6 kJ/mol
2C8H18(l)+25O2(g) =16CO2(g)+18H2O(l) ΔH = -11036 kJ/mol
25℃、101kPa条件下,CO2与H2反应生成辛烷(以C8H18表示)和液态水的热化学方程式是_________。
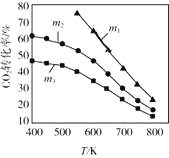
(2)CO2催化加氢合成乙醇的反应原理是:2CO2(g)+6H2(g)![]() C2H5OH(g)+3H2O(g) △H =-173.6 kJ/mol图是起始投料不同时,CO2的平衡转化率随温度的变化关系,m为起始时的投料比,即m=
C2H5OH(g)+3H2O(g) △H =-173.6 kJ/mol图是起始投料不同时,CO2的平衡转化率随温度的变化关系,m为起始时的投料比,即m=![]() 。m1、m2、m3投料比从大到小的顺序为_________,理由是_________。
。m1、m2、m3投料比从大到小的顺序为_________,理由是_________。
(3)在Cu/ZnO催化剂存在下,将CO2与H2混合可合成甲醇,同时发生以下两个平行反应:
反应Ⅰ CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH1=-53.7 kJ/mol
CH3OH(g)+H2O(g) ΔH1=-53.7 kJ/mol
反应Ⅱ CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH2=+41.2 kJ/mol
CO(g)+H2O(g) ΔH2=+41.2 kJ/mol
控制一定的CO2和H2初始投料比,在相同压强下,经过相同反应时间测得如下实验数据(其中“甲醇选择性”是指转化的CO2中生成甲醇的百分比):
实验序号 | T/K | 催化剂 | CO2转化率/% | 甲醇选择性/% |
实验1 | 543 | Cu/ZnO纳米棒 | 12.3 | 42.3 |
实验2 | 543 | Cu/ZnO纳米片 | 10.9 | 72.7 |
实验3 | 553 | Cu/ZnO纳米棒 | 15.3 | 39.1 |
实验4 | 553 | Cu/ZnO纳米片 | 12.0 | 71.6 |
①对比实验1和实验3可发现:同样催化剂条件下,温度升高,CO2转化率升高, 而甲醇的选择性却降低,请解释甲醇选择性降低的可能原因_______________;
②对比实验1和实验 2可发现:在同样温度下,采用Cu/ZnO纳米片使CO2转化率降低, 而甲醇的选择性却提高,请解释甲醇的选择性提高的可能原因____________。
③有利于提高CO2转化为CH3OH平衡转化率的措施有_______。
a.使用Cu/ZnO纳米棒做催化剂
b.使用Cu/ZnO纳米片做催化剂
c.降低反应温度
d.投料比不变,增加反应物的浓度
e.增大![]() 的初始投料比
的初始投料比
(4)以纳米二氧化钛膜为工作电极,稀硫酸为电解质溶液,在一定条件下通入CO2,电解,在阴极可制得低密度聚乙烯![]() (简称LDPE)。
(简称LDPE)。
①电解时,阴极的电极反应式是_____________。
②工业上生产1.4×104 kg 的LDPE,理论上需要标准状况下______L 的CO2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是A、B、C、D、E、F等几种常见有机物之间的转化关系图:
![]()
A是面粉中的主要成分,C与E反应可生成F,D能与新制的氢氧化铜悬浊液反应产生红色沉淀。
根据以上信息完成下列各题:
(1)A的化学式为________,B的结构简式为___________。
(2)F在稀硫酸中发生水解反应的化学方程式为_____________。
(3)E与小苏打溶液反应的化学方程式为___________。
(4)其中能与新制氢氧化铜悬浊液反应产生红色沉淀的物质除D外还有________(填符号)。
(5)钠与C的反应现象和钠与水的反应现象有哪些不同________?为何会产生这些差异________?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com