
科目:高中化学 来源: 题型:
合成氨的热化学方程式为N2(g)+3H2(g)  2NH3(g
2NH3(g ) ΔH=-92.4 kJ·mol-1。现将1 mol N2(g)、3 mol H2(g)充入一容积为2 L的密闭容器中,在500 ℃下进行反应,10 min时达到平衡,NH3的体积分数为φ,下列说法中正确的是
) ΔH=-92.4 kJ·mol-1。现将1 mol N2(g)、3 mol H2(g)充入一容积为2 L的密闭容器中,在500 ℃下进行反应,10 min时达到平衡,NH3的体积分数为φ,下列说法中正确的是

A.若达到平衡时,测得体系放出9.24 kJ热量,则H2反应速率变化曲线如图甲所示
B.反应过程中,混合气体平均相对分子质量为M,混合气体密度为d,混合气体压强为p,三者关系如图乙
C.如图丙所示,容器Ⅰ和Ⅱ达到平衡时所需要的时间可能不同
D.若起始加入物料为1 mol N2,3 mol H2,在不同条件下达到平衡时,NH3的体积分数变化如图丁所示
查看答案和解析>>
科目:高中化学 来源: 题型:
下列除去杂质的方法中错误的是 ( )
|
| 物质 | 杂质 | 除杂质的方法 |
| A | CaCl2溶液 | HCl | 过量CaCO3、过滤 |
| B | KNO3溶液 | AgNO3 | 过量NaCl溶液、过滤 |
| C | FeCl2溶液 | CuCl2 | 过量铁粉、过滤 |
| D | CO2 | H2O | 通过盛浓硫酸的洗气瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.天然油脂的分子中含有酯基,属于酯类
B.苯的分子式为C6H6,分子中的碳原子远远没有饱和,因此能和氯水发生加成反应
C.所有卤代烃都难溶于水,且都是密度比水大的液体
D.天然气与液化石油气的成分相同,与水煤气的成分不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
卤代烃是一类重要的有机合成中间体,是许多有机合成的原料。根据卤代烃的相关性质,回答下列问题.
 (1)化合物A的分子式是
(1)化合物A的分子式是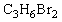 ,A的氢核磁共振氢谱图如图所示,则A的结构简式为 。
,A的氢核磁共振氢谱图如图所示,则A的结构简式为 。
(2)某同学用如图1装置(铁架台、酒精灯等略)验证取代反应和消去反应的产物。
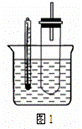
实验操作Ⅰ:在试管中加入5 mL 1 mol/L NaOH溶液和0.5 mL溴乙烷振荡。
实验操作Ⅱ:将试管如图1固定后,水浴加热。
①据图1:用水浴加热而不直接用酒精灯加热的原因是 。
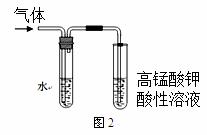
②图2是为证明溴乙烷在NaOH乙醇溶液中加热发生的是消去反应.
i实验中需要检验的产物是 ,水的作用是 ,实验现象是 。
ii若将“酸性高锰酸钾溶液”换成“Br2的CCl4溶液”,还需要装水的洗气装置吗? (填“需要”或“不需要”),理由是 。
iii所检验的产物与Br2的CCl4溶液反应的化学方程式为 。
| 物质 | 熔点/℃ | 沸点/℃ |
| CH3CH2Br | -119 | 38 |
| BrCH2CH2Br | 9 | 131 |
| CH3CH2OH | -114 | 78 |
⑶已知:
分离溴乙烷与1,2-二溴乙烷混合气体的方法是 。
a.冰水浴冷却→过滤 b.水浴冷却→蒸馏
c.冰水浴冷却→加水萃取→分液 d.水浴冷却→加水萃取→分液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质中所含分子的物质的量最大的是 ( )
A.标准状况下22.4LCl2 B.56gN2
C.1.5molO2 D.3.01×1023个硫酸分子
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是( )
A.氯化铵溶液呈酸性:NH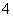 NH3+H+
NH3+H+
B.氢硫酸的电离:H2S2H++S2-
C.向小苏打溶液中加入醋酸溶液:HCO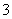 +H+CO2↑+H2O
+H+CO2↑+H2O
D.在标准状况下,向10 mL 0.1 mol·L-1的FeBr2溶液中通入22.4 mL Cl2:2Fe2++2Br-+2Cl2===2Fe3++Br2+4Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
碘在科研与生活中有重要应用。某兴趣小组用0.50 mol·L-1 KI、0.2%淀粉溶液、0.20 mol·L-1 K2S2O8、0.10 mol·L-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响。
已知:S2O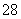 +2I-===2SO
+2I-===2SO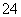 +I2 (慢)
+I2 (慢)
I2+2S2O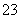 ===2I-+S4O
===2I-+S4O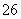 (快)
(快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的________耗尽后,溶液颜色将由无色变为蓝色。为确保能观察到蓝色,S2O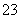 与S2O
与S2O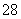 初始的物质的量需满足的关系为:n(S2O
初始的物质的量需满足的关系为:n(S2O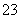 )∶n(S2O
)∶n(S2O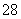 )________。
)________。
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
| 实验序号 | 体积V/mL | ||||
| K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
| ① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
| ② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
| ③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
表中Vx=________,理由是________________________________________
___________________________________________________________________。
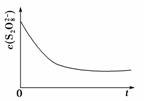
(3)已知某条件下,浓度c(S2O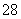 )~反应时间t的变化曲线如图所示,若保持其他条件不变,请在坐标图中,分别画出降低反应温度和加入催化剂时c(S2O
)~反应时间t的变化曲线如图所示,若保持其他条件不变,请在坐标图中,分别画出降低反应温度和加入催化剂时c(S2O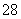 )~t的变化曲线示意图(进行相应的标注)。
)~t的变化曲线示意图(进行相应的标注)。
(4)碘也可用作心脏起搏器电源——锂碘电池的材料。
该电池反应为:2Li(s)+I2(s)===2LiI(s) ΔH
已知:4Li(s)+O2(g)===2Li2O(s) ΔH1
4LiI(s)+O2(g)===2I2(s)+2Li2O(s) ΔH2
则电池反应的ΔH=________;碘电极作为该电池的________极。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com