
【题目】重要的化学品M和N的合成路线如图所示: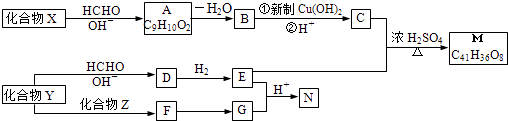
已知:i. ![]()
ii. ![]()
iiiN的结构简式是: 
请回答下列问题:
(1)A中含氧官能团名称是 , C 与E生成M的反应类型是 .
(2)写出下列物质的结构简式:X:Z:E:
(3)C和甲醇反应的产物可以发生聚合反应.该聚合反应的产物是: .
(4)1molG一定条件下,最多能与mol H2发生反应
(5)写出一种符合下列要求G的同分异构体①有碳碳叄键 ②能发生银镜反应 ③一氯取代物只有2种
(6)1,3﹣丙二醇是重要的化工物质,请设计由乙醇合成它的流程图合成路线流程图示例如下:CH2=CH2 ![]() CH3CH2Br
CH3CH2Br ![]() CH3CH2OH.
CH3CH2OH.
【答案】
(1)羟基、醛基;酯化反应
(2)![]() ;CH2=CHCHO;
;CH2=CHCHO;![]()
(3)
(4)3
(5)CH3C≡CCH2CHO或CH3CH2C≡CCHO等
(6)![]()
【解析】解:有机物X与HCHO发生信息i的反应,结合A的分子式为C9H10O2可知,X为 ![]() ,A为
,A为  ,A发生消去反应脱去1分子H2O生成B,故B为
,A发生消去反应脱去1分子H2O生成B,故B为  ,B氧化生成C为
,B氧化生成C为  ;由信息iii中N的结构,结合信息ii中反应以及M的分子式C41H36O8可知,形成M的物质为
;由信息iii中N的结构,结合信息ii中反应以及M的分子式C41H36O8可知,形成M的物质为  、
、 ![]() ,所以E为
,所以E为 ![]() ,C与E通过酯化反应生成M;由Y到E的转化,结合E的结构可知,Y不含苯环,再结合G的结构可知,化合物Z中含有苯环,结合反应信息i可知,Y为CH3CHO,由N的结构,结合信息ii中反应可知,E、G分别为CH2=CHCH=CHCHO、
,C与E通过酯化反应生成M;由Y到E的转化,结合E的结构可知,Y不含苯环,再结合G的结构可知,化合物Z中含有苯环,结合反应信息i可知,Y为CH3CHO,由N的结构,结合信息ii中反应可知,E、G分别为CH2=CHCH=CHCHO、 ![]() 中的一种,由E的结构可知G为CH2=CHCH=CHCHO,比较G与Y的结构可知,Z为CH2=CHCHO,Y和Z发生加成反应得F为CH2=CHCH(OH)CH2CHO,F发生消去反应得G,Y与甲醛发生加成反应得D为(HOCH2)3CCHO,D与氢气发生加成反应得E,(1)由上述分析可知,A为
中的一种,由E的结构可知G为CH2=CHCH=CHCHO,比较G与Y的结构可知,Z为CH2=CHCHO,Y和Z发生加成反应得F为CH2=CHCH(OH)CH2CHO,F发生消去反应得G,Y与甲醛发生加成反应得D为(HOCH2)3CCHO,D与氢气发生加成反应得E,(1)由上述分析可知,A为  ,含有羟基、醛基,C与E通过酯化反应生成M, 所以答案是:羟基、醛基,酯化反应;(2)由上述分析可知,X的结构简式是
,含有羟基、醛基,C与E通过酯化反应生成M, 所以答案是:羟基、醛基,酯化反应;(2)由上述分析可知,X的结构简式是 ![]() ,Z为 CH2=CHCHO,E为
,Z为 CH2=CHCHO,E为 ![]() ,所以答案是:
,所以答案是: ![]() ;CH2=CHCHO;
;CH2=CHCHO; ![]() ;(3)C为
;(3)C为  ;
;  和甲醇发生酯化反应得到的产物再发生加聚反应生成高聚物为
和甲醇发生酯化反应得到的产物再发生加聚反应生成高聚物为  ,所以答案是:
,所以答案是:  ;(4)G为CH2=CHCH=CHCHO,1mol G一定条件下,最多能与3mol H2发生反应,所以答案是:3;(5)G为CH2=CHCH=CHCHO,根据条件①有碳碳叄键,②能发生银镜反应,说明有醛基,③一氯取代物只有2种,则符合要求的G的一种同分异构体为CH3C≡CCH2CHO或CH3CH2C≡CCHO等,所以答案是:CH3C≡CCH2CHO或CH3CH2C≡CCHO等;(6)乙醇合成1,3﹣丙二醇,可以将乙醇氧化成乙醛,用乙醛再与甲醛发生加成后再还原即可得到1,3﹣丙二醇,合成路线为
;(4)G为CH2=CHCH=CHCHO,1mol G一定条件下,最多能与3mol H2发生反应,所以答案是:3;(5)G为CH2=CHCH=CHCHO,根据条件①有碳碳叄键,②能发生银镜反应,说明有醛基,③一氯取代物只有2种,则符合要求的G的一种同分异构体为CH3C≡CCH2CHO或CH3CH2C≡CCHO等,所以答案是:CH3C≡CCH2CHO或CH3CH2C≡CCHO等;(6)乙醇合成1,3﹣丙二醇,可以将乙醇氧化成乙醛,用乙醛再与甲醛发生加成后再还原即可得到1,3﹣丙二醇,合成路线为 ![]() ,所以答案是:
,所以答案是: ![]()
【考点精析】通过灵活运用有机物的结构和性质,掌握有机物的性质特点:难溶于水,易溶于汽油、酒精、苯等有机溶剂;多为非电解质,不易导电;多数熔沸点较低;多数易燃烧,易分解即可以解答此题.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】FeCl3(aq)与KSCN(aq)混合时平衡:Fe3+(aq)+SCN﹣(aq)Fe(SCN)2+(aq);已知平衡时,物质的量浓度c[Fe(SCN)2+]与温度T三关系如图所示,则下列说法正确的是( ) 
A.FeCl3(aq)与KSCN(aq)反应是放热反应
B.温度为T1、T2时,反应的平衡常数分别为K1、K2 , 则K1<K2
C.反应处于D点时,一定有V正>V逆
D.A点与B点相比,A点的c(Fe3+)大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)Si(s)+4HCl(g);△H=+Q kJmol﹣1(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ
C.反应4 min时,若HCl浓度为0.12 molL﹣1 , 则H2反应速率为0.03 molL﹣1min﹣1
D.当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 molL﹣1的NaOH溶液恰好反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,向饱和的氢氧化钠溶液中加入少量的过氧化钠,充分反应后,恢复原来的温度,下列说法正确的是
A. 溶液中![]() 浓度增大,有
浓度增大,有![]() 放出 B. 溶液pH不变,有固体析出,有
放出 B. 溶液pH不变,有固体析出,有![]() 放出
放出
C. 溶液中![]() 数目增多,有
数目增多,有![]() 放出 D. 溶液中
放出 D. 溶液中![]() 数目不变,有
数目不变,有![]() 放出
放出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢的沸点比水高,但受热容易分解。某试剂厂先制得7~8%的过氧化氢溶液,再浓缩成30%的溶液时,可采用的适宜方法是( )
A.常压蒸馏
B.减压蒸馏
C.加生石灰常压蒸馏
D.加压蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸是重要的氧化剂,铁、铜是生活中常见的金属.
(1)Fe与Cu混合物与65%的硝酸反应会产生大量NO2 , 该反应使用的硝酸的物质的量浓度为mol/L(已知ρ=1.4g/cm3).
(2)各为0.1mol的Cu与Fe混合物与足量的某浓度的硝酸反应产生4.48L气体(标准状况下),则该反应消耗的硝酸为mol.
(3)4.4gFe与Cu混合物与过量的硝酸反应,放出的气体与标准状况下的1.12L的氧气混合后通入水中恰好被完全吸收,则其中铜的质量为g.
(4)Fe与Cu混合物共有a mol,其中铜的物质的量分数为X,将该混合物全部投入b mol的硝酸中使其充分反应,假定硝酸的还原产物仅有NO,①若溶液中金属离子只有Fe2+、Cu2+时,则b的取值范围是(用a、x表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分:
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
4 | ⑨ | ⑩ |
针对表中的①~⑩号元素,用元素符号或化学式填空:
(1)在这些元素中,最易失电子的元素是____,非金属性最强的元素是____。
(2)化学性质最不活泼的元素是____,其原子结构示意图为__________。
(3)元素的最高价氧化物对应的水化物中呈两性的氢氧化物与氢氧化钠溶液反应的离子方程式是______________________________。
(4)在②⑤⑦⑨四种元素中,原子半径由大到小的顺序是___________________
(5)在③④⑥三种元素中,离子半径由大到小的顺序是___________________。
(6)元素⑥、⑩的最高价氧化物对应的水化物中,酸性较强的是___________________。
(7)请设计实验证明⑦原子得电子能力比⑥原子强_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂排放的工业废水中可能含有K+、H+、Mg2+、SO42—、Cl—、NO3— 离子。经检测废水呈明显的碱性,则可确定该厂废水中肯定不含有的离子组合是( )
A. H+、K+、NO3— B. K+、NO3—、SO42—
C. H+、Mg2+ D. K+、Mg2+、SO42—、Cl—
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com