
|
| A.氨水 | B.氢氧化钠 | C.盐酸 | D.硫酸 |
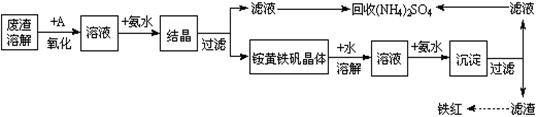
科目:高中化学 来源:不详 题型:填空题
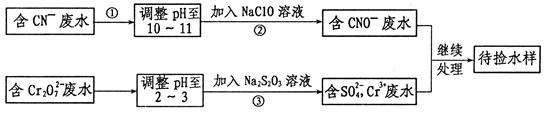
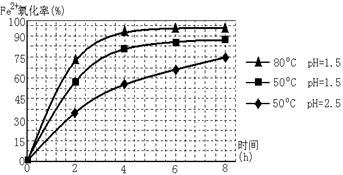
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.工业上制粗硅:SiO2 + C Si + CO2↑ Si + CO2↑ |
B.海水提镁的主要步骤为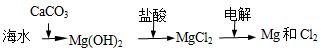 |
C.海水提溴原理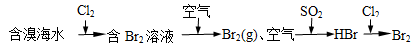 |
| D.硫酸工业的接触室、合成氨工业的合成塔和氯碱工业的电解槽都有热交换器 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.从沸腾炉出来的炉气需净化,因为炉气中SO3会与杂质反应 |
| B.硫铁矿燃烧前需要粉碎,因为大块的不能燃烧 |
| C.SO3用98.3%的浓硫酸吸收,目的是防止形成酸雾,以便使SO3吸收完全 |
| D.SO2氧化为SO3时需要使用催化剂,这样可以提高SO2的转化率 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.合成氨生产中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 |
| B.联合制碱法是将二氧化碳和氨气通入饱和氯化钠溶液中,制得碳酸氢钠,再在高温下灼烧,转化为碳酸钠。 |
| C.硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量 |
| D.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的C12进入阳极室 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 O
O  Na2CO3
Na2CO3 +CO2↑+H2O
+CO2↑+H2O  所以在溶液中首先结晶析出
所以在溶液中首先结晶析出 碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。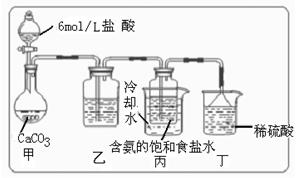
 (Ⅰ)乙装置中的试剂是
(Ⅰ)乙装置中的试剂是 
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.“接触法”制H2SO4过程中,选择98%的浓硫酸作为SO3的吸收剂 |
B.海水提镁的主要步骤为: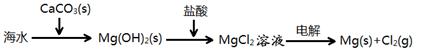 |
| C.侯德榜制碱法最终制得的是纯碱 |
D.高炉炼铁过程 中的还原剂主要是CO 中的还原剂主要是CO |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
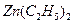 .
.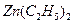 可以与水反应生成氧化锌和乙烷。用化学(离子)方程式表示该方法生成氧化锌的方法______。
可以与水反应生成氧化锌和乙烷。用化学(离子)方程式表示该方法生成氧化锌的方法______。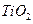 ) 替代明矾,钛白粉的一种工业制法是以钛铁矿(主要成分
) 替代明矾,钛白粉的一种工业制法是以钛铁矿(主要成分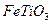 ),为原料按下过程进行的,请
),为原料按下过程进行的,请 完成下列化学方程式
完成下列化学方程式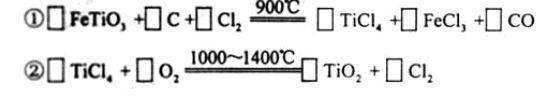
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
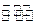 2NH3(g) △H=-92.44 kJ/mol。其部分工艺流程如下图所示:
2NH3(g) △H=-92.44 kJ/mol。其部分工艺流程如下图所示: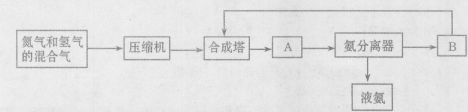
 ,阴极反应为 。
,阴极反应为 。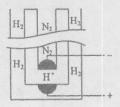
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com