
【题目】二草酸合铜(II)酸钾晶体{K2[Cu(C2O4)2]·2H2O}(其相对式量为354),是一种工业用化工原料。微溶于冷水,可溶于热水,微溶于酒精,干燥时较为稳定,加热时易分解。现以胆矾和草酸为原料制备二草酸合铜( II)酸钾晶体流程如下:

(已知:H2C2O4![]() CO↑十CO2↑+H2O)
CO↑十CO2↑+H2O)
请回答:
(1)第①步操作要微热溶解,其原因是加快溶解速率和________。
(2)为了将滤纸上的黑色固体充分转移到热的KHC2O4溶液中,以下操作方案中最合理的是______。
A.用水溶解滤纸上的黑色固体,然后将溶液转入热的KHC2O4溶液中
B.用硫酸溶液溶解滤纸上的氧化铜,然后转入热的KHC2O4溶液中
C.黑色固体连同滤纸一起加入到热的KHC204溶液中,待充分反应后趁热过滤
D.先将黑色固体转入溶液中,再在空气中灼烧滤纸,将剩余的固体转入热的KHC2O4溶液中
(3)50℃水浴加热至反应充分,写出该反应的化学方程式___________。
(4)步骤③所用的洗涤剂最合适的是_______。
(5)二草酸合铜(II)酸钾晶体的制备也可以用CuSO4晶体和K2C2O4溶液反应得到。从硫酸铜溶液中获得硫酸铜晶体的实验步骤为:加入适量乙醇、蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
①加入适量乙醇的优点有:
a.缩短加热的时间,降低能耗;b.________ 。
②在蒸发浓缩的初始阶段可通过_______(填操作名称)回收乙醇。
(6)准确称取制取的晶体试样l.000g溶于NH3·H2O中,并加水定容至250mL,取试样溶液25.00mL于锥形瓶中,再加入l0mL 3.000mol/L的H2SO4溶液,用0.01000mol/L的KMnO4溶液滴定,消耗KMnO4标准液20.00mL,则该产品的纯度是_______ 。
【答案】 可避免H2C2O4分解 C CuO+2KHC2O4![]() K2[Cu(C2O4)2]+H2O 热水 降低硫酸铜的溶解度,有利于硫酸铜晶体析出 蒸馏 88.50%
K2[Cu(C2O4)2]+H2O 热水 降低硫酸铜的溶解度,有利于硫酸铜晶体析出 蒸馏 88.50%
【解析】本题考查化学工艺流程,(1)草酸受热易分解,第①步操作微热溶解原因是加快溶解速率和防止H2C2O4分解;(2)A、黑色固体为CuO,CuO不溶于水,故A错误;B、引入SO42-新的杂质,故B错误;C、此操作方案可行,故C正确;D、灼烧滤纸,然后转入热的KHC2O4溶液,容易引入新的杂质,故D错误;(3)CuO和KHC2O4反应生成二草酸合铜(II)酸钾晶体,因此化学反应方程式为CuO+2KHC2O4![]() K2[Cu(C2O4)2]+H2O;(4)根据题中所给信息,二草酸合铜(II)酸钾微溶于冷水,可溶于热水,微溶于酒精,根据流程,③得到的是滤液,因此所用的洗涤剂为热水;(5)①b.硫酸铜不溶于乙醇,因此使用乙醇可以降低硫酸铜的溶解度,有利于硫酸铜晶体的析出;②乙醇易挥发,因此可通过蒸馏的方法回收乙醇;(6)根据得失电子数目守恒,因此有n(MnO4-)×5=n(C2O42-)×2×(4-3),解得n(C2O42-)=20.00×10-3×0.01000×5/2mol=5×10-4mol,即二草酸合铜(II)酸钾物质的量为5×10-4/2mol=2.5×10-4mol,产品的纯度为
K2[Cu(C2O4)2]+H2O;(4)根据题中所给信息,二草酸合铜(II)酸钾微溶于冷水,可溶于热水,微溶于酒精,根据流程,③得到的是滤液,因此所用的洗涤剂为热水;(5)①b.硫酸铜不溶于乙醇,因此使用乙醇可以降低硫酸铜的溶解度,有利于硫酸铜晶体的析出;②乙醇易挥发,因此可通过蒸馏的方法回收乙醇;(6)根据得失电子数目守恒,因此有n(MnO4-)×5=n(C2O42-)×2×(4-3),解得n(C2O42-)=20.00×10-3×0.01000×5/2mol=5×10-4mol,即二草酸合铜(II)酸钾物质的量为5×10-4/2mol=2.5×10-4mol,产品的纯度为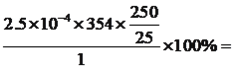 88.50%。
88.50%。


 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
【题目】下列措施对增大反应速率明显有效的是
A. Na与水反应时增大水的用量
B. 将锌与稀硫酸反应时,向溶液中加入少量CuSO4晶体
C. Fe与稀硫酸反应制取氢气时,改用浓硫酸
D. 用碳还原Fe2O3冶炼铁时,增大碳的用量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以电石渣(主要成分为Ca(OH)2和CaCO3)为原料制备KClO3的流程如下:
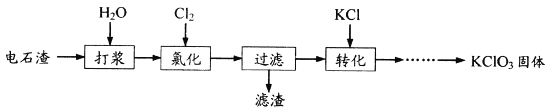
下列说法不正确的是
A. 氯化过程中主反应为:6Ca(OH)2+6Cl2= Ca(ClO3)2+5CaCl2+6H2O
B. 适当减缓通Cl2速率,充分搅拌浆料,加水使Ca(OH)2完全溶解,均有利于氯气的吸收
C. 滤液中Ca(ClO3)2与CaCl2的物质的量之比n[Ca(ClO3)2]:n[CaCl2]=1:5
D. 向滤液中加入稍过量KC1固体可将Ca(ClO3)2转化为KClO3,通过蒸发浓缩、冷却结晶的方法析出KClO3晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,所选装置或实验设计合理的是

A. 图⑤所示装置中盛有饱和NaOH溶液用以除去CO2中含有的少量HCl气体
B. 用乙醇提取碘水中的碘选择图③所示装置
C. 用图①和②所示装置进行粗盐提纯
D. 用图④所示装置可把由5种沸点相差较大的液体组成的混合物中的成分一一分离出来
查看答案和解析>>
科目:高中化学 来源: 题型:
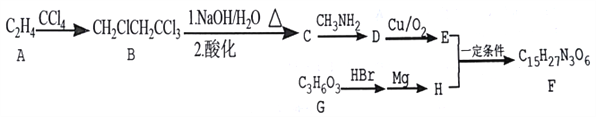
【题目】某药物中间体F的合成流程如下:
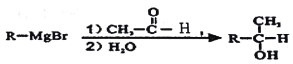
已知:(1) ![]() ;
;
(2)碳碳双键与羟基相连不稳定
请回答:
(1)A→B的反应类型为_____________。
(2)有关物质D的叙述错误的是______(填序号)。
A.能使KMnO4溶液褪色 B.能缩聚成高分子
C.能与甲醇发生酯化反应 D.能发生水解反应
(3)B→C过程中反应1的化学方程式为____________。
(4)F的结构简式为_____________。
(5)写出满足下述条件的E的同分异构体____________。
①水解产物能消耗2molNaOH;②分子中有三种不同类型的氢;③只含一个甲基
(6)结合题给信息,以乙烯为原料制备2-丁醇,设计合成路线(其他试剂任选) ____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L容积不变的容器中,发生N2+3H22NH3的反应.现通入4molH2和4molN2,10s内用H2表示的反应速率为0.12mol/(Ls),则10s后容器中N2的物质的量是
A.3.6molB.3.2molC.2.8molD.1.6mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的铁粉加入100mL稀硫酸中,为中和过量硫酸,且使Fe2+完全转化为Fe(OH)2,共消耗掉2mol·L-1NaOH溶液150mL。原硫酸溶液的浓度是
A. 0.5mol·L-1 B. 1mol·L-1 C. 1.5mol·L-1 D. 2mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酮洛芬是一种良好的抗炎镇痛药,可以通过以下方法合成:

(1)化合物D中所含官能团的名称为__________________和_____________________。
(2)化合物E的结构简式为__________________;由B→C的反应类型是____________。
(3)写出C→D的反应方程式____________________________________。
(4)B的同分异构体有多种,其中同时满足下列条件的有_____种。
I.属于芳香族化合物
II.能发生银镜反应
III.其核磁共振氢谱有5组波峰,且面积比为1:1:1:1:3
(5)请写出以甲苯为原料制备化合物![]() 的合成路线流程图____(无机试剂可任选)。合成路线流程图示例如图:
的合成路线流程图____(无机试剂可任选)。合成路线流程图示例如图:![]() 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com