
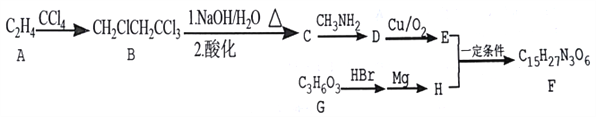
【题目】某药物中间体F的合成流程如下:
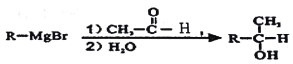
已知:(1) ![]() ;
;
(2)碳碳双键与羟基相连不稳定
请回答:
(1)A→B的反应类型为_____________。
(2)有关物质D的叙述错误的是______(填序号)。
A.能使KMnO4溶液褪色 B.能缩聚成高分子
C.能与甲醇发生酯化反应 D.能发生水解反应
(3)B→C过程中反应1的化学方程式为____________。
(4)F的结构简式为_____________。
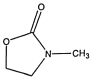
(5)写出满足下述条件的E的同分异构体____________。
①水解产物能消耗2molNaOH;②分子中有三种不同类型的氢;③只含一个甲基
(6)结合题给信息,以乙烯为原料制备2-丁醇,设计合成路线(其他试剂任选) ____________。
【答案】 加成反应 BC CH2ClCH2CCl3+5NaOH![]()
 +4NaCl十2H2O
+4NaCl十2H2O 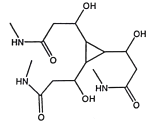
 、
、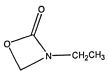 、
、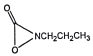 、(HCO)2NCH2CH3
、(HCO)2NCH2CH3 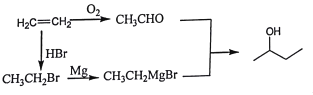
【解析】本题考查有机物的合成和推断,(1)A的分子式为C2H4,其结构简式为CH2=CH2,A→B根据反应前后结构简式,得出发生的反应是加成反应;(2)B→C发生的卤代烃的水解和酸性强的制取酸性弱的,以及根据信息(2)得出:C的结构简式为HOCH2CH2COOH,C与CH3NH2发生取代反应,即D的结构简式为HOCH2CH2CONHCH3,A、根据结构简式,D中羟基,能被酸性高锰酸钾溶液氧化,故A说法正确;B、只有羟基,没有羧基,因此不能缩聚成高分子化合物,故B说法错误;C、不含羧基,不能与甲醇发生酯化反应,故C说法错误;D、含有![]() ,因此能发生水解反应,故D说法正确;(3)根据(2)的分析,反应方程式为CH2ClCH2CCl3+5NaOH
,因此能发生水解反应,故D说法正确;(3)根据(2)的分析,反应方程式为CH2ClCH2CCl3+5NaOH![]()
 +4NaCl十2H2O;(4)根据上述分析,以及信息,E的结构简式为OHCCH2CONHCH3,根据G的分子式,可以推出G的结构简式可能为HOCH2CH2COOH、CH3CH(OH)COOH、
+4NaCl十2H2O;(4)根据上述分析,以及信息,E的结构简式为OHCCH2CONHCH3,根据G的分子式,可以推出G的结构简式可能为HOCH2CH2COOH、CH3CH(OH)COOH、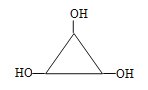 ,H的结构简式可能为BrMgCH2CH2COOH、CH3CH(COOH)MgBr、
,H的结构简式可能为BrMgCH2CH2COOH、CH3CH(COOH)MgBr、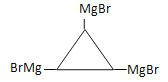 ,根据F的分子式,因此G的结构简式为
,根据F的分子式,因此G的结构简式为 ,H的结构简式为
,H的结构简式为 ,则F的结构简式为
,则F的结构简式为 ;(5)①能水解说明含有酯基或
;(5)①能水解说明含有酯基或![]() ,产物能消耗2molNaOH,说明水解后某产物含有2个羧基,,符合条件的同分异构体为(HCO)2NCH2CH3 、
,产物能消耗2molNaOH,说明水解后某产物含有2个羧基,,符合条件的同分异构体为(HCO)2NCH2CH3 、 、
、 、
、 ;(6)乙烯制备CH3CH(OH)CH2CH3,根据题中所给已知,合成路线为
;(6)乙烯制备CH3CH(OH)CH2CH3,根据题中所给已知,合成路线为 。
。


科目:高中化学 来源: 题型:
【题目】咖啡酸具有止血功效,存在于多种中药中,其结构简式为 。
。
(1)写出咖啡酸中两种含氧官能团的名称:________;
(2)根据咖啡酸的结构,列举三种咖啡酸可以发生的反应类型:________、________、________;
(3)蜂胶的分子式为C17H16O4,在一定条件下可水解生成咖啡酸和一种醇A,则醇A的分子式为________。
(4)已知醇A含有苯环,且分子结构中无甲基,写出醇A在一定条件下与乙酸反应的化学方程式:___________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.原子及其离子的核外电子层数等于该元素所在的周期数
B.元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
C.稀有气体原子的最外层电子数都是8
D.同一元素的各种同位素的物理性质、化学性质均相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将aL NH3完全溶于1L水得到VmL氨水,溶液的密度为ρg/cm3(ρ<1),溶质的质量分数为ω,溶质的物质的量浓度为cmol/L。下列叙述中正确的是
①![]() ②
②![]() ③
③![]() ④
④![]()
⑤上述溶液中再加入VmL水后,所得溶液的质量分数大于0.50ω
A. ①②④ B. ②③④ C. ②④ D. ②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二草酸合铜(II)酸钾晶体{K2[Cu(C2O4)2]·2H2O}(其相对式量为354),是一种工业用化工原料。微溶于冷水,可溶于热水,微溶于酒精,干燥时较为稳定,加热时易分解。现以胆矾和草酸为原料制备二草酸合铜( II)酸钾晶体流程如下:

(已知:H2C2O4![]() CO↑十CO2↑+H2O)
CO↑十CO2↑+H2O)
请回答:
(1)第①步操作要微热溶解,其原因是加快溶解速率和________。
(2)为了将滤纸上的黑色固体充分转移到热的KHC2O4溶液中,以下操作方案中最合理的是______。
A.用水溶解滤纸上的黑色固体,然后将溶液转入热的KHC2O4溶液中
B.用硫酸溶液溶解滤纸上的氧化铜,然后转入热的KHC2O4溶液中
C.黑色固体连同滤纸一起加入到热的KHC204溶液中,待充分反应后趁热过滤
D.先将黑色固体转入溶液中,再在空气中灼烧滤纸,将剩余的固体转入热的KHC2O4溶液中
(3)50℃水浴加热至反应充分,写出该反应的化学方程式___________。
(4)步骤③所用的洗涤剂最合适的是_______。
(5)二草酸合铜(II)酸钾晶体的制备也可以用CuSO4晶体和K2C2O4溶液反应得到。从硫酸铜溶液中获得硫酸铜晶体的实验步骤为:加入适量乙醇、蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
①加入适量乙醇的优点有:
a.缩短加热的时间,降低能耗;b.________ 。
②在蒸发浓缩的初始阶段可通过_______(填操作名称)回收乙醇。
(6)准确称取制取的晶体试样l.000g溶于NH3·H2O中,并加水定容至250mL,取试样溶液25.00mL于锥形瓶中,再加入l0mL 3.000mol/L的H2SO4溶液,用0.01000mol/L的KMnO4溶液滴定,消耗KMnO4标准液20.00mL,则该产品的纯度是_______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种Cu- Li可充电电池的工作原理如图所示,其中非水系电解液和水系电解液被锂离子固体电解质陶瓷片( LISICON)隔开。下列说法正确的是
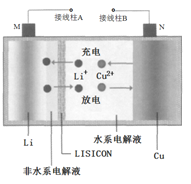
A. 陶瓷片允许水分子通过
B. 电池放电时,N极上发生氧化反应
C. 电池充电时,接线柱B应与外接直流电源的负极相连
D. 电池充电时,阴极反应为Li++e-=Li
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.(1)图I表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为4,则量筒中液体的体积是①,由于放置位置不当读数时俯视,读出的数值为②则①②的正确数值为___________

A①3.2mL、②小于3.2mL B.①4.8mL、②大于4.8mL
C.①3.2mL、②大于3.2mL D.①4.8mL、②小于4.8mL
(2)实验室需配制1mol·L-1的NaOH溶液200mL,在用托盘天平称取NaOH固体时,天平读数为________填代号,下同)。
A.大于8.0g B.小于8.0g C.8.0g
II.表示溶液浓度的方法通常有两种;溶液中溶质的质量分数(W)和物质的量浓度 (c),因此在配制溶液时,根据不同的需要,有不同的配制方法。请完成下列填空题。
(1)用10%(密度为1.01g/cm3)的氢氧化钠溶液配制成27.5g 2%的氢氧化钠溶液。
①计算:需_________g 10%(密度为1.01g/cm3)的氢氧化钠溶液
②量取:用_________mL量筒量取10%的氢氧化钠溶液
(2)把98%(密度为1.84g/cm3)的浓硫酸稀释成2mol/L的稀硫酸100mL,回答下列问题:
①需要量取浓硫酸_______ mL
②下列实验操作使配制的溶液浓度偏的是__________
A.容量瓶洗涤后未干燥
B.量取溶液时,仰视刻度线
C.装入试剂瓶时,有少量溶液溅出
D.没有洗涤烧杯和玻璃棒
E.定容时,加水不慎超出刻度线,又倒出一些
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有硫酸镁溶液500mL,它的密度是1.20g·cm3,其中镁离子的质量分数是4.8%,则有关该溶液的说法不正确的是
A. 溶质的质量分数是24% B. 溶液的物质的量浓度是2.4mol·L1
C. 溶质和溶剂的物质的量之比约为1∶21.1 D. 硫酸根离子的质量是230.4g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组设计实验探究NO与铜粉的反应并检验NO,实验装置如图所示(夹持装置略)。实验开始前,向装置中通入一段时间的N2,排尽装置内的空气。

已知:在溶液中.FeSO4+NO![]() [Fe(NO)]SO4(棕色),该反应可用于检验NO。下列说法不正确的是
[Fe(NO)]SO4(棕色),该反应可用于检验NO。下列说法不正确的是
A. 装置F、I中的试剂依次为水、硫酸亚铁溶液
B. 若观察到装置H中红色粉末变黑色,则NO与Cu发生了反应
C. 实验结束后,先熄灭酒精灯,再关闭分液漏斗的活塞
D. 装置J收集的气体中一定不含NO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com