
【题目】三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2。其反应原理为
①C3N3(OH)3![]() 3HNCO
3HNCO
②8HNCO+6NO2![]() 7N2+8CO2+4H2O
7N2+8CO2+4H2O
下列说法正确的是( )
A.反应①是氧化还原反应
B.反应②中HNCO是氧化剂
C.反应②中,每转移1 mol电子,消耗NO2 0.25 mol
D.反应②中氧化剂、还原剂的物质的量之比为4∶3
科目:高中化学 来源: 题型:
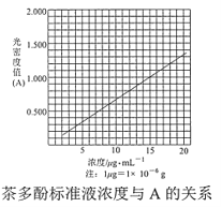
【题目】茶叶中的茶多酚是一种天然抗氧化剂(其抗氧化能力是VC的5~10倍),它易溶于水、乙醇、乙酸乙酯,难溶于氯仿。在酸性介质中,茶多酚能将Fe3+还原为Fe2+,Fe2+与K3Fe(CN)6生成的深蓝色配位化合物KFe[Fe(CN)6]对特定波长光的吸收程度(用光密度值A表示)与茶多酚在一定浓度范围内成正比。A与茶多酚标准液浓度的关系如图所示:
某实验小组设计如下实验流程从茶叶中提取茶多酚:
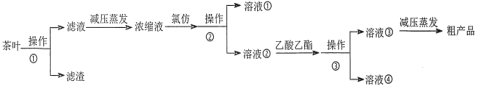
请回答下列问题:
(1)操作①用水浸取茶多酚时,实验小组发现搅拌速度对茶多酚浸出量的影响如图1所示,原因是_____。若用乙醇浸取茶多酚操作如下:称取 10 g 茶叶末,用滤纸包好,装入________________中,圆底烧瓶内加___________和适量乙醇,如图2安装后, 通冷凝水,加热套加热,当乙醇被加热沸腾后,控制加热套温度在 90℃。为使恒压漏斗内液面高出茶叶包约 0.5 cm,并保持约 1 h,可行的操作方法是_________。
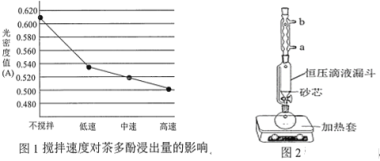
(2)减压蒸发相对于一般蒸发的优点是_____________;氯仿的作用是_________________。
(3)下列有关实验基本操作不正确的是____________。
A.图2中冷凝水流向为a进b出
B.分液漏斗使用前须检验是否漏水并洗净备用
C.操作①过滤时,可用玻璃棒适当搅拌以加快分离速度
D.萃取过程中,经振摇并放气后,将分液漏斗置于铁圈上立即分液
(4)称取 1.25 g 粗产品,用蒸馏水溶解并定容至 1000 mL,移取该溶液 1.00 mL,加过量 Fe3+和_______酸性溶液,用蒸馏水定容至 100 mL 后,测得溶液光密度值 A=0.800,则产品的纯度是______(以质量分数表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学对影响 CuSO4 溶液和浓氨水反应产物的因素进行了如下探究。
(查阅资料)
①Cu(OH)2(s) Cu2+ + 2OH- Ksp = 2.2×10-20;![]() Cu2+ + 4NH3 K = 4.8×10-14
Cu2+ + 4NH3 K = 4.8×10-14
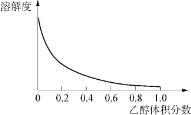
②Cu(NH3)4SO4·H2O 是一种易溶于水、难溶于乙醇的深蓝色固体, 加热分解有氨气放出。Cu(NH3)4SO4·H2O 在乙醇-水混合溶剂中的溶解度如下图所示。
(实验 1)CuSO4 溶液和浓氨水的反应。
序号 | 实验内容 | 实验现象 |
1-1 | 向 2 mL 0.1 mol/L CuSO4(pH=3.2)中逐滴加入 2 mL 1 mol/L 氨水 | 立即出现浅蓝色沉淀,溶液变无色; 随后沉淀逐渐溶解,溶液变为蓝色;最终得到澄清透明的深蓝色溶液 A |
1-2 | 向 2 mL 1 mol/L 氨水中逐滴加入 2 mL 0.1 mol/L CuSO4(pH=3.2) | 始终为澄清透明的深蓝色溶液 B |
(1)进一步实验证明,深蓝色溶液 A、B 中均含有![]() ,相应的实验方案为______________________(写出实验操作及现象)。
,相应的实验方案为______________________(写出实验操作及现象)。
(实验 2)探究影响 CuSO4 溶液和浓氨水反应产物的因素。
序号 | 实验内容 | 实验现象 |
2-1 | 向实验 1-2 所得深蓝色溶液 B 中继续加入 2 mL 0.1 mol/L CuSO4(pH=3.2) | 有浅蓝色沉淀生成,溶液颜色变浅 |
2-2 | 向实验 1-2 所得深蓝色溶液 B 中继续加入 1 mol/L NaOH | 有浅蓝色沉淀生成,上层清液接近无色 |
2-3 | 向 2 mL 0.1 mol/L 氨水中逐滴加入2 mL 0.1 mol/L CuSO4(pH=3.2) | 有浅蓝色沉淀生成,上层清液接近无色 |
(2)依据实验 2-1,甲同学认为 Cu2+浓度是影响 CuSO4 溶液和浓氨水反应产物的因素之一。乙同学认为实验 2-1 没有排除硫酸铜溶液呈酸性的干扰,并设计了如下对比实验:
序号 | 实验内容 | 实验现象 |
2-4 | 向实验 1-2 所得深蓝色溶液 B 中继续加入 2 mL 试剂 a | 无明显现象 |
①用化学用语表示硫酸铜溶液呈酸性的原因:___________________________。
②试剂 a 为 ___________________________。
(3)利用平衡移动原理对实验 2-2 的现象进行解释:____________________________。
(4)实验 2-3 的目的是__________________________。
(5)综合上述实验可以推测, 影响 CuSO4 溶液和浓氨水反应产物的因素有________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验说法,不正确的是( )
A.碱液不慎溅到手上,先用大量水冲洗,再用饱和硼酸溶液洗,最后用水冲洗
B.![]() 和
和![]() 的混合物经溶解、过滤,洗涤、干燥,可分离出
的混合物经溶解、过滤,洗涤、干燥,可分离出![]()
C.用容量瓶配制溶液,定容时若加水超过刻度线,立即用滴管吸出多余液体
D.火柴头的浸泡液中滴加![]() 溶液,稀
溶液,稀![]() 和
和![]() 溶液,可检验火柴头是否含有氯元素
溶液,可检验火柴头是否含有氯元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(含氧化铝、氧化铁)制取铝的过程如下:
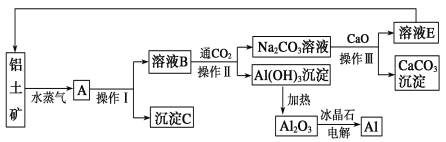
请回答下列问题:
(1)沉淀C的化学式为____,C与金属Al可以在高温下发生反应,可用于焊接铁轨。则该反应的化学方程式为_________。
(2)操作Ⅰ、操作Ⅱ 和操作Ⅲ 都是____(填操作名称),实验室要洗涤Al(OH)3沉淀,洗涤方法是____________。
(3)生产过程中,除NaOH、H2O可以循环使用外,还可以循环使用的物质有______(填化学式)。用此法制取铝的副产品是______(填化学式)。
(4)金属铝的生产是以Al2O3为原料,在熔融状态下进行电解:![]() ,电解熔融的氧化铝,若得到标准状况下11.2 L O2,则同时生成____g铝。
,电解熔融的氧化铝,若得到标准状况下11.2 L O2,则同时生成____g铝。
下列有关此工艺的说法合理的是______
A.冰品石(Na3AlF6)的作用是降低Al2O3的熔化温度
B.电解生成的金属铝是在熔融液的上层
C.电解过程中的电极材料可以为金属材料
D.铝是高耗能产品,废旧铝材的回收后制成氧化铝比较合理
(5)若铝土矿中还含有二氧化硅,此生产过程中得到的氧化铝将混有杂质:___(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸雨形成的原理之一如下:
含硫燃料![]() A
A![]() B
B![]() 硫酸
硫酸
请回答下列问题:
(1)A物质的化学式为________,B物质的化学式为________。
(2)三个反应中,不属于氧化还原反应的是________(填序号)。
(3)SO2中硫元素显+4价,它可以降低到0价,利用这一性质可在工厂的烟道气中通入合适的________(填“氧化剂”或“还原剂”)除去SO2,达到减少污染的目的。
(4)火力发电厂燃烧的煤中含有大量的硫,其排出的废气中往往含有SO2、O2、N2、CO2等。为了除去有害的SO2气体,在英国已进行了一个研究,结果表明:高烟囱可以有效降低地面SO2的浓度。在20世纪60年代到70年代的10年间,由发电厂排放的SO2增加了35%,但由于高烟囱的建造,地面SO2浓度降低了30%之多。
①你认为减少酸雨产生的途径可采取的措施是________。
A.少用煤作燃料 B.把工厂的烟囱造高
C.燃料脱硫 D.把工厂迁移到农村
E.开发新能源
②请从全球环境保护的角度,分析这种建高烟囱的方法是否可取?________,理由是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氯碱工业中,离子交换膜法电解饱和食盐水示意图如下,下列说法不正确的是( )

离子交换膜
A.电极A为阳极,发生氧化反应生成氯气
B.离子交换膜为阳离子交换膜
C.饱和NaCl从a处进,NaOH溶液从d处出
D.OH-迁移的数量等于导线上通过电子的数量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生欲配制6.0mol/L的H2SO4 1000 mL,实验室有三种不同浓度的硫酸:
①480mL 0.5mol/L 的硫酸;②150mL 25%的硫酸(ρ=1.18g/mL);③足量的18mol/L的硫酸。有三种规格的容量瓶:250mL、500mL、1000mL。老师要求把①②两种硫酸全部用完,不足的部分由③来补充。
请回答下列问题:
(1)实验所用25%的硫酸的物质的量浓度为______mol/L(保留1位小数)。
(2)配制该硫酸溶液应选用容量瓶的规格为______mL。
(3)配制时,该同学的操作顺序如下,请将操作步骤B、D补充完整。
A.将①②两溶液全部在烧杯中混合均匀;
B.用量筒准确量取所需的18mol/L的浓硫酸____mL,沿玻璃棒倒入上述混合液中。并用玻璃棒搅拌,使其混合均匀;
C.将混合均匀的硫酸沿玻璃棒注入所选的容量瓶中;
D._________________________________________________________________________________________________________________________________
E.振荡,继续向容量瓶中加水,直到液面接近刻度线1~2cm处;
F.改用胶头滴管加水,使溶液的凹液面恰好与刻度线相切;
G.将容量瓶盖紧,振荡,摇匀。
(4)如果省略操作D,对所配溶液浓度有何影响?________(填“偏大”、“偏小”或“无影响”)。
(5)进行操作C前还需注意____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在指定条件下,下列各组离子一定能大量共存的是( )
A.滴加甲基橙试剂显红色的溶液中:Na、Fe2、Cl-、NO3-
B.滴入KSCN显血红色的溶液中:NH4、Al3、NO3-、SO42-
C.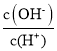 =1012的溶液中:NH4+、K+、Cl-、HCO3-
=1012的溶液中:NH4+、K+、Cl-、HCO3-
D.由水电离的c(H+)=1.0×l0-13mol/L溶液中:K、Al3、SO42-、CH3COO-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com