
【题目】在氯碱工业中,离子交换膜法电解饱和食盐水示意图如下,下列说法不正确的是( )

离子交换膜
A.电极A为阳极,发生氧化反应生成氯气
B.离子交换膜为阳离子交换膜
C.饱和NaCl从a处进,NaOH溶液从d处出
D.OH-迁移的数量等于导线上通过电子的数量
【答案】D
【解析】
氯碱工业中的总反应为2Cl-+2H2O 2OH-+H2↑+Cl2↑;电解池中阳极失电子发生氧化反应,氯碱工业中Cl2为氧化产物,所以电极A为阳极,电极B为阴极,据此作答。
2OH-+H2↑+Cl2↑;电解池中阳极失电子发生氧化反应,氯碱工业中Cl2为氧化产物,所以电极A为阳极,电极B为阴极,据此作答。
A.根据分析可知电极A为阳极,发生氧化反应生成氯气,故A正确;
B.阳极发生的方程式为:2Cl--2e-═Cl2↑,阴极:2H++2e-═H2↑;为了防止生成的氯气与氢氧化钠发生反应,氢氧化钠要从b口流出,所以要防止OH-流向阳极即电极A,该离子交换膜为阳离子交换膜,故B正确;
C.根据B选项的分析可知饱和NaCl从a处进,NaOH溶液从d处出,故C正确;
D.根据总反应方程式可知当反应中转移4mol电子时,生成2mol OH-,故D错误;
故答案为D。


科目:高中化学 来源: 题型:
【题目】一种水系锌离子电池总反应式为xZn+Zn1-xMn2O4![]() ZnMn2O4.(0<x<1)。下列说法错误的是( )
ZnMn2O4.(0<x<1)。下列说法错误的是( )
A.充电时,阳极的电极反应式为Zn1-xMn2O4+xZn2++2xe-=ZnMn2O4
B.放电时,Zn2+向正极迁移
C.充放电过程中锌与锰的化合价都发生变化
D.放电时,每转移1mole-正极质量增加32.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2。其反应原理为
①C3N3(OH)3![]() 3HNCO
3HNCO
②8HNCO+6NO2![]() 7N2+8CO2+4H2O
7N2+8CO2+4H2O
下列说法正确的是( )
A.反应①是氧化还原反应
B.反应②中HNCO是氧化剂
C.反应②中,每转移1 mol电子,消耗NO2 0.25 mol
D.反应②中氧化剂、还原剂的物质的量之比为4∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.强酸、强碱、重金属盐等可使蛋白质变性
B.用新制氢氧化铜悬浊液(必要时可加热)能鉴别甲酸、乙醇、乙醛
C.乙酸乙酯中混有的乙酸,可加入足量的饱和![]() 溶液,经分液除去
溶液,经分液除去
D.向苯和苯酚的混合液中加入浓溴水,充分反应后过滤,可除去苯中少量的苯酚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的恒容密闭容器中发生反应A(g)+2B(g)![]() 3C(g)。反应过程中的部分数据如下表所示:
3C(g)。反应过程中的部分数据如下表所示:
n/mol t/min | n(A) | n(B) | n(C) |
0 | 2.0 | 2.4 | 0 |
5 | 0.9 | ||
10 | 1.6 | ||
15 | 1.6 |
下列说法正确的是( )
A.0~5min用A表示的平均反应速率为0.09mol·L-1·min-1
B.该反应在10min后才达到平衡
C.物质B的平衡转化率为20%
D.平衡状态时,c(C)=0.6mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乳酸乙酯( )是一种食用香料,常用于调制果香型、乳酸型食用和酒用精。乳酸乙酯的同分异构体M有如下性质:0.1mol M分别与足量的金属钠和碳酸氢钠反应,产生的气体在相同状况下的体积相同,则M的结构最多有(不考虑空间异构)
)是一种食用香料,常用于调制果香型、乳酸型食用和酒用精。乳酸乙酯的同分异构体M有如下性质:0.1mol M分别与足量的金属钠和碳酸氢钠反应,产生的气体在相同状况下的体积相同,则M的结构最多有(不考虑空间异构)
A. 8种B. 9种C. 10种D. 12种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活和社会密切相关。下列有关说法不正确的是![]()
A.发展“低碳经济”能够减少对化石能源的依赖
B.明矾溶于水会生成氢氧化铝胶体,故可用明矾作净水剂
C.铁制品在潮湿的空气中生锈,其主要原因是发生了析氢腐蚀
D.处理含![]() 的废水,常用FeS作沉淀剂,是因为CuS的溶解度比FeS小
的废水,常用FeS作沉淀剂,是因为CuS的溶解度比FeS小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辉铜矿(主要成分Cu2S)作为铜矿中铜含量最高的矿物之一,可用来提炼铜和制备含铜化合物。
Ⅰ.湿法炼铜用Fe2(SO4)3溶液作为浸取剂提取Cu2+:
(1)反应过程中有黄色固体生成,写出反应的离子方程式______________________。
(2)控制温度为85℃、浸取剂的pH = 1,取相同质量的辉铜矿粉末分别进行如下实验:
实验 | 试剂及操作 | 3小时后Cu2+浸出率(%) |
一 | 加入10mL 0.25mol·L-1Fe2(SO4)3溶液和5 mL水 | 81.90 |
二 | 加入10 mL0.25mol·L-1Fe2(SO4)3溶液和5mL 0.1mol·L-1H2O2 | 92.50 |
回答:H2O2使Cu2+浸出率提高的原因可能是__________。
(3)实验二在85℃后,随温度升高,测得3小时后Cu2+浸出率随温度变化的曲线如图。Cu2+浸出率下降的原因_________________。
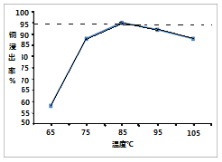
(4)上述湿法炼铜在将铜浸出的同时,也会将铁杂质带进溶液,向浸出液中通入过量的O2并加入适量的CuO,有利于铁杂质的除去,用离子方程式表示O2的作用_________。解释加入CuO的原因是_____。
Ⅱ.某课题组利用碳氨液((NH4)2CO3、NH3·H2O)从辉铜矿中直接浸取铜。
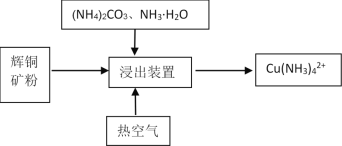
其反应机理如下:
①Cu2S(s)2Cu+(aq) +S2-(aq) (快反应)
②4Cu++O2+2H2O4Cu2++4OH- (慢反应)
③Cu2++4NH3·H2OCu(NH3)42++4H2O(快反应)
(5)提高铜的浸出率的关键因素是 ________。
(6)在浸出装置中再加入适量的(NH4)2S2O8,铜的浸出率有明显升高,结合平衡移动原理说明可能的原因是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com