
【题目】在体积均为1 L,pH均等于2的盐酸和醋酸中,分别投入0.12 g镁粉充分反应后,下图中比较符合反应事实的曲线是
A.AB.BC.CD.D
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】双功能手性催化剂在药物合成中起到重要的作用。其中一种催化剂I的合成路线如下:
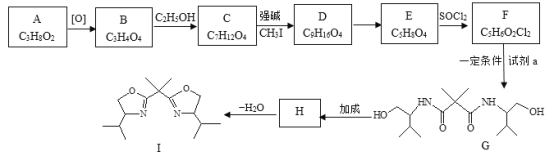
已知:R-NH2+![]()
![]()
![]()
(1)A可与Na反应可生成H2,则A中的官能团名称是_________。
(2)下列关于A的说法中,正确的是_________。
a.与乙醇互为同系物
b.与B在一定条件下可发生缩聚反应
c.发生消去反应的试剂和条件是:NaOH的醇溶液、加热
(3)写出B→C的化学方程式:___________。
(4)D的结构简式是__________。
(5)E→F的反应类型是___________。
(6)已知:NH3+![]() →H2N-CH2CH2OH,NH3和物质K发生反应可以制备试剂a,K的结构简式是__________。
→H2N-CH2CH2OH,NH3和物质K发生反应可以制备试剂a,K的结构简式是__________。
(7)F与对苯二胺(![]() )在一定条件下可发生缩聚反应制备尼龙MXD6的衍生品,该反应的化学方程式是___________。
)在一定条件下可发生缩聚反应制备尼龙MXD6的衍生品,该反应的化学方程式是___________。
(8)H的结构简式是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下的一密闭容器中事先放入1.56g过氧化钠,然后再通入乙烷与氧气的混合气体,用电火花引爆,直至反应完全为止,恢复到原温度,容器内压强近似为零。
(1)相同条件下,通入的气体氧气和乙烷的体积比是多少?_____
(2)通入氧气的质量最大应是多少?_____
查看答案和解析>>
科目:高中化学 来源: 题型:
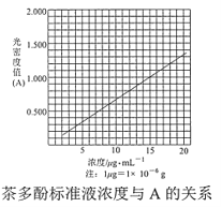
【题目】茶叶中的茶多酚是一种天然抗氧化剂(其抗氧化能力是VC的5~10倍),它易溶于水、乙醇、乙酸乙酯,难溶于氯仿。在酸性介质中,茶多酚能将Fe3+还原为Fe2+,Fe2+与K3Fe(CN)6生成的深蓝色配位化合物KFe[Fe(CN)6]对特定波长光的吸收程度(用光密度值A表示)与茶多酚在一定浓度范围内成正比。A与茶多酚标准液浓度的关系如图所示:
某实验小组设计如下实验流程从茶叶中提取茶多酚:
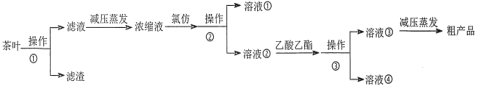
请回答下列问题:
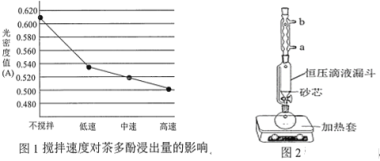
(1)操作①用水浸取茶多酚时,实验小组发现搅拌速度对茶多酚浸出量的影响如图1所示,原因是_____。若用乙醇浸取茶多酚操作如下:称取 10 g 茶叶末,用滤纸包好,装入________________中,圆底烧瓶内加___________和适量乙醇,如图2安装后, 通冷凝水,加热套加热,当乙醇被加热沸腾后,控制加热套温度在 90℃。为使恒压漏斗内液面高出茶叶包约 0.5 cm,并保持约 1 h,可行的操作方法是_________。
(2)减压蒸发相对于一般蒸发的优点是_____________;氯仿的作用是_________________。
(3)下列有关实验基本操作不正确的是____________。
A.图2中冷凝水流向为a进b出
B.分液漏斗使用前须检验是否漏水并洗净备用
C.操作①过滤时,可用玻璃棒适当搅拌以加快分离速度
D.萃取过程中,经振摇并放气后,将分液漏斗置于铁圈上立即分液
(4)称取 1.25 g 粗产品,用蒸馏水溶解并定容至 1000 mL,移取该溶液 1.00 mL,加过量 Fe3+和_______酸性溶液,用蒸馏水定容至 100 mL 后,测得溶液光密度值 A=0.800,则产品的纯度是______(以质量分数表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】洛匹那韦(Lopinavir)是抗艾滋病毒常用药,在“众志成城战疫情”中,洛匹那韦,利托那韦合剂被用于抗新型冠状病毒(2019-nCoV)。洛匹那韦的合成路线可设计如图:

回答下列问题:
(1)A的化学名称是_______;A制备B反应的化学方程式为_________(注明反应条件)。
(2)D生成E的反应类型为_____;F中能与氢气发生加成反应的官能团名称为___。
(3)C的分子式为_____;一定条件下,C能发生缩聚反应,化学方程式为_____。
(4)K2CO3具有碱性,其在制备D的反应中可能的作用是______。
(5)X是C的同分异构体,写出一种符合下列条件的X的结构简式______。
①含有苯环,且苯环上的取代基数目≤2
②含有硝基
③有四种不同化学环境的氢,个数比为6:2:2:1
(6)已知:CH3COOH![]() CH3COCl,(2,6-二甲基苯氧基)乙酰氯(
CH3COCl,(2,6-二甲基苯氧基)乙酰氯( )是由G合成洛匹那韦的原料之一,写出以2,6-二甲基苯酚、ClCH2COOCH2CH3、K2CO3为原料制各该物质的合成路线________(其它无机试剂任选)。
)是由G合成洛匹那韦的原料之一,写出以2,6-二甲基苯酚、ClCH2COOCH2CH3、K2CO3为原料制各该物质的合成路线________(其它无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定用以上方法制得的四氧化三铁中可能含有的杂质,同学们又进行了下列实验探究。
[查阅资料]
资料一:难溶性碱受热时能分解产生金属氧化物和水(反应中各种元素的化合价不变);
资料二:氧化铁和一氧化碳反应是随温度升高而逐步进行的,先生成四氧化三铁,再生成氧化亚铁(黑色),最后生成铁。
[提出猜想]
四氧化三铁中可能含有的杂质是氧化铁和氧化亚铁中的一种或两种。
[实验设计]
同学们称取了23.28 g该四氧化三铁样品进行了下列实验:
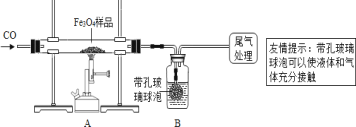
[实验分析]
因探究思路不同,兴趣小组分成甲、乙两小组。
甲组:
(1)该组同学欲通过B装置反应前后的质量变化来计算确认该四氧化三铁样品中的杂质,B中的最佳试剂是___(填序号)。
①澄清石灰水 ②氢氧化钠浓溶液 ③稀盐酸 ④水
(2)上述实验过程中,一氧化碳气体除作为反应物外,还能起到的作用是:①实验开始时,排尽装置中的空气,防止加热时发生爆炸;②停止加热后,防止A中生成物被氧化,B中的溶液倒吸入A中;③____。
(3)乙组同学认为B装置反应前后的质量差会偏小而影响计算、分析,你认为他们的理由是____。
乙组:利用仪器测定并绘制成反应过程中A装置中玻璃管内的固体质量随温度的变化曲线(如图):
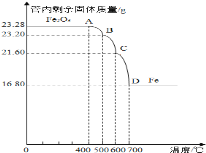
(1)写出BC段发生反应的化学方程式____________。
(2)通过计算确定:该四氧化三铁样品中含有的杂质是_____,其中含四氧化三铁的质量是__g。(不需要写过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标况下将8.96 L氯化氢气体溶于水形成100 mL溶液,然后与足量的铁屑反应。
(1)所得盐酸溶液的物质的量浓度是多少________?
(2)参加反应的铁的质量是多少________?
(3)标况下生成氢气的体积是多少________?
(4)将生成的氯化亚铁配成400 mL溶液,此溶液中氯化亚铁的物质的量浓度是多少________?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学对影响 CuSO4 溶液和浓氨水反应产物的因素进行了如下探究。
(查阅资料)
①Cu(OH)2(s) Cu2+ + 2OH- Ksp = 2.2×10-20;![]() Cu2+ + 4NH3 K = 4.8×10-14
Cu2+ + 4NH3 K = 4.8×10-14
②Cu(NH3)4SO4·H2O 是一种易溶于水、难溶于乙醇的深蓝色固体, 加热分解有氨气放出。Cu(NH3)4SO4·H2O 在乙醇-水混合溶剂中的溶解度如下图所示。
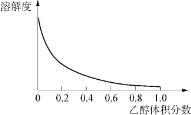
(实验 1)CuSO4 溶液和浓氨水的反应。
序号 | 实验内容 | 实验现象 |
1-1 | 向 2 mL 0.1 mol/L CuSO4(pH=3.2)中逐滴加入 2 mL 1 mol/L 氨水 | 立即出现浅蓝色沉淀,溶液变无色; 随后沉淀逐渐溶解,溶液变为蓝色;最终得到澄清透明的深蓝色溶液 A |
1-2 | 向 2 mL 1 mol/L 氨水中逐滴加入 2 mL 0.1 mol/L CuSO4(pH=3.2) | 始终为澄清透明的深蓝色溶液 B |
(1)进一步实验证明,深蓝色溶液 A、B 中均含有![]() ,相应的实验方案为______________________(写出实验操作及现象)。
,相应的实验方案为______________________(写出实验操作及现象)。
(实验 2)探究影响 CuSO4 溶液和浓氨水反应产物的因素。
序号 | 实验内容 | 实验现象 |
2-1 | 向实验 1-2 所得深蓝色溶液 B 中继续加入 2 mL 0.1 mol/L CuSO4(pH=3.2) | 有浅蓝色沉淀生成,溶液颜色变浅 |
2-2 | 向实验 1-2 所得深蓝色溶液 B 中继续加入 1 mol/L NaOH | 有浅蓝色沉淀生成,上层清液接近无色 |
2-3 | 向 2 mL 0.1 mol/L 氨水中逐滴加入2 mL 0.1 mol/L CuSO4(pH=3.2) | 有浅蓝色沉淀生成,上层清液接近无色 |
(2)依据实验 2-1,甲同学认为 Cu2+浓度是影响 CuSO4 溶液和浓氨水反应产物的因素之一。乙同学认为实验 2-1 没有排除硫酸铜溶液呈酸性的干扰,并设计了如下对比实验:
序号 | 实验内容 | 实验现象 |
2-4 | 向实验 1-2 所得深蓝色溶液 B 中继续加入 2 mL 试剂 a | 无明显现象 |
①用化学用语表示硫酸铜溶液呈酸性的原因:___________________________。
②试剂 a 为 ___________________________。
(3)利用平衡移动原理对实验 2-2 的现象进行解释:____________________________。
(4)实验 2-3 的目的是__________________________。
(5)综合上述实验可以推测, 影响 CuSO4 溶液和浓氨水反应产物的因素有________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氯碱工业中,离子交换膜法电解饱和食盐水示意图如下,下列说法不正确的是( )

离子交换膜
A.电极A为阳极,发生氧化反应生成氯气
B.离子交换膜为阳离子交换膜
C.饱和NaCl从a处进,NaOH溶液从d处出
D.OH-迁移的数量等于导线上通过电子的数量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com