
【题目】双功能手性催化剂在药物合成中起到重要的作用。其中一种催化剂I的合成路线如下:
已知:R-NH2+![]()
![]()
![]()
(1)A可与Na反应可生成H2,则A中的官能团名称是_________。
(2)下列关于A的说法中,正确的是_________。
a.与乙醇互为同系物
b.与B在一定条件下可发生缩聚反应
c.发生消去反应的试剂和条件是:NaOH的醇溶液、加热
(3)写出B→C的化学方程式:___________。
(4)D的结构简式是__________。
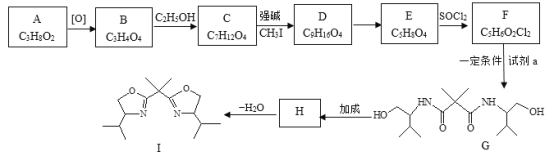
(5)E→F的反应类型是___________。
(6)已知:NH3+![]() →H2N-CH2CH2OH,NH3和物质K发生反应可以制备试剂a,K的结构简式是__________。
→H2N-CH2CH2OH,NH3和物质K发生反应可以制备试剂a,K的结构简式是__________。
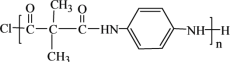
(7)F与对苯二胺(![]() )在一定条件下可发生缩聚反应制备尼龙MXD6的衍生品,该反应的化学方程式是___________。
)在一定条件下可发生缩聚反应制备尼龙MXD6的衍生品,该反应的化学方程式是___________。
(8)H的结构简式是___________。
【答案】羟基 b HOOC—CH2—COOH + 2C2H5OH![]() C2H5OOC—CH2—COOC2H5 + 2H2O
C2H5OOC—CH2—COOC2H5 + 2H2O ![]() 取代
取代  n
n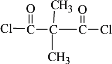 +n
+n![]()
![]()
 +(2n-1)HCl
+(2n-1)HCl 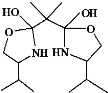
【解析】
根据已知反应R-NH2+![]()
![]()
![]() ,由F在一定条件下与试剂a反应生成G
,由F在一定条件下与试剂a反应生成G![]() 以及F的分子式C5H6O2Cl2,可推出F为
以及F的分子式C5H6O2Cl2,可推出F为![]() ,而a为
,而a为![]() ,E与SOCl2反应生成F,可知E为
,E与SOCl2反应生成F,可知E为![]() ,根据逆推示可知D为
,根据逆推示可知D为![]() ,C为C2H5OOCCH2COOC2H5,B为HOOC—CH2—COOH,A为HOCH2CH2CH2OH,
,C为C2H5OOCCH2COOC2H5,B为HOOC—CH2—COOH,A为HOCH2CH2CH2OH, ![]() 加成反应生成H,H脱去水生成
加成反应生成H,H脱去水生成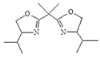 ,加成时应形成环,推出H为
,加成时应形成环,推出H为 ,据此分析。
,据此分析。
(1)A为HOCH2CH2CH2OH,可与Na反应可生成H2,则A中的官能团名称是羟基;
(2)A为HOCH2CH2CH2OH,a.与乙醇所含有羟基数目不相同,结构不相似,不互为同系物,故错误;b.与B分别为二元醇和二元羧酸,在一定条件下可发生缩聚反应,故正确;c.发生消去反应的试剂和条件是:浓硫酸、加热,故错误;答案选b;
(3)B→C是HOOC—CH2—COOH与C2H5OH发生酯化反应生成C2H5OOC—CH2—COOC2H5和水,反应的化学方程式为:HOOC—CH2—COOH + 2C2H5OH![]() C2H5OOC—CH2—COOC2H5 + 2H2O;
C2H5OOC—CH2—COOC2H5 + 2H2O;
(4)D的结构简式是![]() ;
;
(5)E→F是![]() 与SOCl2发生取代反应生成
与SOCl2发生取代反应生成![]() 、二氧化硫和水,反应类型是取代反应;
、二氧化硫和水,反应类型是取代反应;
(6)已知:NH3+![]() →H2N-CH2CH2OH,NH3和物质K发生反应可以制备试剂a
→H2N-CH2CH2OH,NH3和物质K发生反应可以制备试剂a![]() ,为开环加成,则K的结构简式是
,为开环加成,则K的结构简式是 ;
;
(7)F与对苯二胺(![]() )在一定条件下可发生缩聚反应制备尼龙MXD6的衍生品,该反应的化学方程式是n
)在一定条件下可发生缩聚反应制备尼龙MXD6的衍生品,该反应的化学方程式是n +n
+n![]()
![]()
 +(2n-1)HCl;
+(2n-1)HCl;
(8)H的结构简式是 。
。


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种短周期主族元素,它们的原子序数依次增大,其中A元素原子核外电子仅有一种原子轨道,也是宇宙中最丰富的元素,B元素原子的核外p电子数比s电子数少1,C为金属元素且原子核外p电子数和s电子数相等,D元素的原子核外所有p轨道全满或半满。
(1)写出下列四种元素的元素名称:
A:___,B:____,C:____,D:____。
(2)写出C、D两种元素基态原子核外电子排布的电子排布图。C:___,D:___。
(3)写出A、B两种元素单质在一定条件下反应的化学方程式:____。
(4)写出B2A4的电子式:____。
(5)写出C3B2化合物与水反应的方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A.无色透明的溶液中:Fe3+、![]() 、I-、
、I-、![]()
B.0.1 molL-1 KNO3 溶液中:Na+、Fe2+、Cl-、![]()
C.使酚酞变红的溶液中:Na+、Mg2+、![]() 、
、![]()
D. =1×10-12 的溶液:K+、Na+、
=1×10-12 的溶液:K+、Na+、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KAl(SO4)2·12H2O(明矾)是一种复盐,在造纸等方面应用广泛。实验室中,采用废易拉罐(主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如下图所示。回答下列问题:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
(1)为尽量少引入杂质,试剂①应选用________(填标号)。
a.HCl溶液 b.H2SO4溶液 c.氨水 d.NaOH溶液
(2)易拉罐溶解过程中主要反应的化学方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生命起源于原始海洋。科学家认为,由于海洋中铝离子的浓度极低,所以铝元素未成为人体的必需元素,它反倒对人体有害,铝主要损害脑细胞,是老年性痴呆的病因之一。1989年世界卫生组织把铝列为食品污染源之一,每日摄入量应控制在4 mg以下。若炸油条时1 kg面粉需加入0.5 kg水,4 g明矾和10 g小苏打及少量食盐等辅料,经烹炸,成品油条的产率一般为80%,通过计算说明若每天食用100 g油条,则摄入铝的量是
A.0.228 g
B.0.228 mg
C.18.8 mg
D.4 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化铁在印刷、医药、颜料、污水处理以及有机合成催化剂方面有重要的应用。工业上常以废铁屑(含有SiO2、Al2O3、MgO、Fe2O3等杂质)为原料制备氯化铁。其生产流程如图:
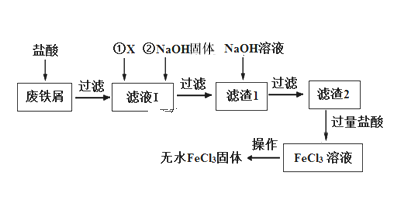
已知:氢氧化物的Ksp如下表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mg(OH)2 |
Ksp | 1.0×10-36 | 1.6×10-14 | 2.0×10-33 | 1.2×10-11 |
请回答下列问题:
(1)物质X可以选用下列物质中的____(选填序号)
A.NaCl B.FeCl3 C.H2O2 D.H2SO4
(2)滤液Ⅰ加入NaOH固体的目的是调节溶液的pH(忽略加入NaOH固体以后溶液体积的变化)。已知滤液Ⅰ中c(Fe3+)为1.0 mol·L-1,c(Al3+)为0.03 mol·L-1,c(Mg2+)为0.01 mol·L-1,当Fe3+恰好沉淀完全时[c(Fe3+)=1×10-5 mol·L-1],Al3+是否已经开始沉淀______(填“是”或“否”)。
(3)写出滤渣1加NaOH溶液发生反应的离子方程式_____________________。
(4)生产流程中最后“从FeCl3溶液得到无水FeCl3固体”的操作分为两步:第一步,先冷却结晶得到FeCl3·6H2O晶体;第二步,制无水FeCl3固体。第二步的正确操作是_____。
(5)FeCl3具有净水作用,但易腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。
①FeCl3净水的原理是____________________(用离子方程式表示)
②通过控制条件生成聚合氯化铁,离子方程式为xFe3++yH2O![]() Fex(OH)y(3x-y)++yH+,欲增加聚合氯化铁的产率可采取的方法是_____(填字母)。
Fex(OH)y(3x-y)++yH+,欲增加聚合氯化铁的产率可采取的方法是_____(填字母)。
a.降温 b.加氨水 c.加入NH4Cl d.加入NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三种有机化合物的键线式如图所示。下列说法错误的是

A. 甲、乙的化学式均为C8H14
B. 乙的二氯代物共有7种(不考虑立体异构)
C. 丙的名称为乙苯,其分子中所有碳原子可能共平面
D. 甲、乙、丙均能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,某气态烷烃和烯烃(含一个双键)的混合气体2.24 L完全燃烧后,将产生的气体缓慢通过浓硫酸,浓硫酸增重4.05 g,剩余气体通过碱石灰,碱石灰增重6.60 g。另再取2.24 L标准状况下的该混合气体,将它通入过量的溴水中,溴水增重1.05 g。
(1)确定混合气体由哪两种烃组成_______。
(2)计算混合气体中两种烃的体积分数_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com