
【题目】洛匹那韦(Lopinavir)是抗艾滋病毒常用药,在“众志成城战疫情”中,洛匹那韦,利托那韦合剂被用于抗新型冠状病毒(2019-nCoV)。洛匹那韦的合成路线可设计如图:

回答下列问题:
(1)A的化学名称是_______;A制备B反应的化学方程式为_________(注明反应条件)。
(2)D生成E的反应类型为_____;F中能与氢气发生加成反应的官能团名称为___。
(3)C的分子式为_____;一定条件下,C能发生缩聚反应,化学方程式为_____。
(4)K2CO3具有碱性,其在制备D的反应中可能的作用是______。
(5)X是C的同分异构体,写出一种符合下列条件的X的结构简式______。
①含有苯环,且苯环上的取代基数目≤2
②含有硝基
③有四种不同化学环境的氢,个数比为6:2:2:1
(6)已知:CH3COOH![]() CH3COCl,(2,6-二甲基苯氧基)乙酰氯(
CH3COCl,(2,6-二甲基苯氧基)乙酰氯( )是由G合成洛匹那韦的原料之一,写出以2,6-二甲基苯酚、ClCH2COOCH2CH3、K2CO3为原料制各该物质的合成路线________(其它无机试剂任选)。
)是由G合成洛匹那韦的原料之一,写出以2,6-二甲基苯酚、ClCH2COOCH2CH3、K2CO3为原料制各该物质的合成路线________(其它无机试剂任选)。
【答案】甲苯 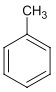 +Cl2
+Cl2![]()
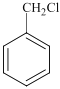 +HCl 取代反应 羰基、碳碳双键 C9H11O2N
+HCl 取代反应 羰基、碳碳双键 C9H11O2N  吸收反应生成的HCl,提高反应转化率
吸收反应生成的HCl,提高反应转化率 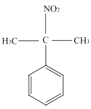 或
或![]()
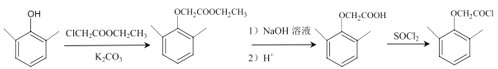
【解析】
甲苯(![]() )与Cl2在光照时发生饱和C原子上的取代反应产生一氯甲苯:
)与Cl2在光照时发生饱和C原子上的取代反应产生一氯甲苯:![]() 和HCl,
和HCl,![]() 与
与![]() 在K2CO3作用下反应产生D,D结构简式是
在K2CO3作用下反应产生D,D结构简式是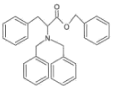 ,D与CH3CN在NaNH2作用下发生取代反应产生E:
,D与CH3CN在NaNH2作用下发生取代反应产生E: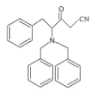 ,E与
,E与![]() 发生反应产生F:
发生反应产生F: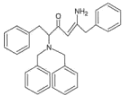 ,F与NaBH4在CH3SO3H作用下发生还原反应产生G:
,F与NaBH4在CH3SO3H作用下发生还原反应产生G: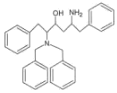 ,G经一系列反应产生洛匹那韦。
,G经一系列反应产生洛匹那韦。
(1)A是![]() ,名称为甲苯,A与Cl2光照反应产生
,名称为甲苯,A与Cl2光照反应产生![]() 和HCl,反应方程式为:
和HCl,反应方程式为:![]() +Cl2
+Cl2![]()
![]() +HCl;
+HCl;
(2)D与CH3CN在NaNH2作用下反应产生E: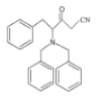 ,是D上的
,是D上的![]() 被-CH2CN取代产生,故反应类型为取代反应;
被-CH2CN取代产生,故反应类型为取代反应;
F分子中的![]() 、
、![]() 与H2发生加成反应形成G,故F中能够与氢气发生加成反应的官能团名称为羰基、碳碳双键;
与H2发生加成反应形成G,故F中能够与氢气发生加成反应的官能团名称为羰基、碳碳双键;
(3)C结构简式为![]() ,可知C的分子式为C9H11O2N;C分子中含有羧基、氨基,一定条件下,能发生缩聚反应,氨基脱去H原子,羧基脱去羟基,二者结合形成H2O,其余部分结合形成高聚物,该反应的化学方程式为:
,可知C的分子式为C9H11O2N;C分子中含有羧基、氨基,一定条件下,能发生缩聚反应,氨基脱去H原子,羧基脱去羟基,二者结合形成H2O,其余部分结合形成高聚物,该反应的化学方程式为: ;
;
(4)K2CO3是强碱弱酸盐,CO32-水解使溶液显碱性,B发生水解反应会产生HCl,溶液中OH-消耗HCl电离产生的H+,使反应生成的HCl被吸收,从而提高反应转化率;
(5)C结构简式是![]() ,分子式为C9H11O2N,C的同分异构体X符合下列条件:①含有苯环,且苯环上的取代基数目≤2;②含有硝基;③有四种不同化学环境的氢,个数比为6:2:2:1,则X可能的结构为
,分子式为C9H11O2N,C的同分异构体X符合下列条件:①含有苯环,且苯环上的取代基数目≤2;②含有硝基;③有四种不同化学环境的氢,个数比为6:2:2:1,则X可能的结构为 或
或![]() ;
;
(6)2,6-二甲基苯酚(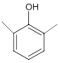 )与ClCH2COOCH2CH3在K2CO3作用下发生取代反应产生
)与ClCH2COOCH2CH3在K2CO3作用下发生取代反应产生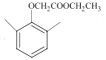 ,该物质与NaOH水溶液加热发生水解反应,然后酸化得到
,该物质与NaOH水溶液加热发生水解反应,然后酸化得到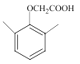 ,
, 与SOCl2发生取代反应产生
与SOCl2发生取代反应产生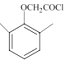 ,故合成路线为
,故合成路线为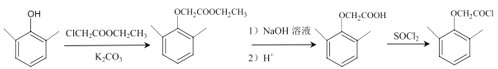 。
。


科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 醋酸溶解水垢中的CaCO3: CaCO3 + 2H+= Ca2++ H2O + CO2↑
B. 惰性电极电解饱和MgCl2溶液: Mg2++2Cl- + 2H2O ![]() Mg(OH)2↓ + H2↑ + Cl2↑
Mg(OH)2↓ + H2↑ + Cl2↑
C. 苯酚钠溶液中通入少量的CO2:![]() +H2O+CO2→
+H2O+CO2→ +
+![]()
D. 用银氨溶液检验乙醛中的醛基:CH3CHO+![]() +2OH-
+2OH-![]() CH3COONH4+H2O+2Ag↓+3NH3↑
CH3COONH4+H2O+2Ag↓+3NH3↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程的离子方程式书写正确的是( )
A.Cu与AgNO3溶液反应: Cu + Ag+![]() Ag + Cu2+
Ag + Cu2+
B.醋酸与氢氧化钠溶液反应: CH3COOH + OH![]() CH3COO + H2O
CH3COO + H2O
C.碳酸氢钠与硫酸反应: CO32 + 2H+![]() CO2↑ + H2O
CO2↑ + H2O
D.氢氧化铁胶体的制备:Fe2+ + 3H2O ![]() Fe(OH)3↓ + 3H+
Fe(OH)3↓ + 3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳元素的单质有多种形式,下图依次是C60、石墨和金刚石的结构图:

回答下列问题:
(1)金刚石、石墨、C60、碳纳米管等都是碳元素的单质形式,它们互为_________。
(2)金刚石、石墨烯(指单层石墨)中碳原子的杂化形式分别为________、________。
(3)C60属于_________晶体,石墨属于________晶体。
(4)石墨晶体中,层内C—C键的键长为142 pm,而金刚石中C—C键的键长为154 pm,其原因是金刚石中只存在C—C间的________共价键,而石墨层内的C—C间不仅存在_________共价键,还有_________键。
(5)金刚石晶胞含有________个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r=________a,列式表示碳原子在晶胞中的空间占有率________(用含π分数形式表示,不要求写成百分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取溴有如下反应:5NaBr+NaBrO3+3H2SO4=3Br2+Na2SO4+3H2O,与该反应在氧化还原反应原理上最相似的是
A.2NaBr+Cl2=2CaCl+Br2
B.AlCl3+3NaAlO2+6H2O=4Al(OH)3↓+3NaCl
C.2H2S+SO2=2H2O+3S↓
D.2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家在利用无土栽培法培养一些名贵花卉时,培养液中添加了多种必需化学元素。其配方如下:
离子 |
|
|
|
|
|
|
|
|
培养液浓度 | 1 | 1 | 0.25 | 1 | 2 | 1 | 0.25 | 1 |
其中花卉根细胞吸收最少的离子是( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝基苯甲酸乙酯在OH-存在下发生水解反应:O2NC6H4COOC2H5+OH-O2NC6H4COOO-+C2H5OH两种反应物的初始浓度均为0.050mol/L,在不同温度下测得O2NC6H4COOC2H5的浓度(mol/L)随时间变化的数据如下表所示。下列有关说法不正确的是( )
t/s | 0 | 120 | 180 | 240 | 330 | 530 | 600 | 700 | 800 |
15℃ | 0.500 | 0.335 | 0.291 | 0.256 | 0.210 | 0.155 | 0.148 | 0.145 | 0.145 |
35℃ | 0.500 | 0.325 | 0.2775 | 0.238 | 0.190 | … | 0.135 | 0.135 | 0.135 |
A. 该反应在![]() ,120180s区间内O2NC6H4COOC2H5平均反应速率为7.33×10 -4 mol·L-1·s-1
,120180s区间内O2NC6H4COOC2H5平均反应速率为7.33×10 -4 mol·L-1·s-1
B. 由数据可知,随着反应的进行,反应物的浓度降低,反应速率减慢
C. 530s时,表格中35℃对应的数据一定是0.135
D. 由数据可知,温度升高反应速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以含锂电解铝废渣(主要含 AlF3、 NaF、LiF、CaO ) 和浓硫酸为原料,制备电池级碳酸锂,同时得副产品冰晶石,其工艺流程如下:

已知LiOH易溶于水,Li2CO3微溶于水。回答下列问题:
(1)电解铝废渣与浓硫酸反应产生的气体化学式为 ___________。滤渣2的主要成分是(写化学式)_________。
(2)碱解反应中, 同时得到气体和沉淀反应的离子方程式为_____________。
(3)一般地说 K>105 时,该反应进行得就基本完全了。苛化反应中存在如下平衡:Li2CO3(s)+Ca2+(aq)2Li+(aq)+ CaCO3(s)通过计算说明该反应是否进行完全________(已知Ksp(Li2CO3) = 8.64×10-4、Ksp(CaCO3) = 2.5×10-9)。
(4)碳化反应后的溶液得到Li2CO3的具体实验操作有:加热浓缩、______、______、干燥。
(5)上述流程得到副产品冰晶石的化学方程式为__________。
(6)Li2CO3是制备金属锂的重要原料, 一种制备金属锂的新方法获得国家发明专利,其装置如图所示:

工作时电极 C 应连接电源的______极,阳极的电极反应式为__________ 。该方法设计的 A 区能避免熔融碳酸锂对设备的腐蚀和因________逸出对环境的污染。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由下列实验及现象不能推出相应结论的是( )
实验 | 现象 | 结论 | |
A | 向 | 黄色逐渐消失,加 | 还原性: |
B | 将金属钠在燃烧匙中点燃,迅速伸入集满 | 集气瓶中产生大量白烟,瓶内有黑色颗粒产生 |
|
C | 向某溶液中先加入氯水,再加入 | 加入 | 最初溶液中含有 |
D | 向2支盛有 | 两只试管中固体均溶解 | 氧化铝是两性氧化物 |
A. AB. BC. CD. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com