
【题目】下列过程的离子方程式书写正确的是( )
A.Cu与AgNO3溶液反应: Cu + Ag+![]() Ag + Cu2+
Ag + Cu2+
B.醋酸与氢氧化钠溶液反应: CH3COOH + OH![]() CH3COO + H2O
CH3COO + H2O
C.碳酸氢钠与硫酸反应: CO32 + 2H+![]() CO2↑ + H2O
CO2↑ + H2O
D.氢氧化铁胶体的制备:Fe2+ + 3H2O ![]() Fe(OH)3↓ + 3H+
Fe(OH)3↓ + 3H+
【答案】B
【解析】
A. Cu与AgNO3发生置换反应,生成硝酸铜和银单质,方程式为:Cu + 2AgNO3![]() 2Ag + Cu( NO3)2,离子方程式为:Cu + 2Ag+
2Ag + Cu( NO3)2,离子方程式为:Cu + 2Ag+![]() 2Ag + Cu2+,A项错误;
2Ag + Cu2+,A项错误;
B. 醋酸与氢氧化钠溶液反应,生成醋酸钠和水,反应方程式为:CH3COOH + NaOH![]() CH3COONa + H2O,离子方程式为:CH3COOH + OH
CH3COONa + H2O,离子方程式为:CH3COOH + OH![]() CH3COO + H2O,B项正确;
CH3COO + H2O,B项正确;
C. 碳酸氢钠与硫酸反应,生成硫酸钠、水和CO2,反应方程式为:NaHCO3 +H2SO4![]() 2CO2↑ + 2H2O+Na2SO4,离子方程式为:HCO3 + H+
2CO2↑ + 2H2O+Na2SO4,离子方程式为:HCO3 + H+![]() CO2↑ + H2O,C项错误;
CO2↑ + H2O,C项错误;
D. 氢氧化铁胶体的制备方程式为:FeCl3 + 3H2O ![]() Fe(OH)3(胶体)+ 3HCl,离子方程式为:Fe3+ + 3H2O
Fe(OH)3(胶体)+ 3HCl,离子方程式为:Fe3+ + 3H2O ![]() Fe(OH)3 (胶体)+ 3H+,D项错误;
Fe(OH)3 (胶体)+ 3H+,D项错误;
答案选B。


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】某学习小组对人教版教材实验“在200mL烧杯中放入20g蔗糖(C12H22O11),加入适量水,搅拌均匀,然后再加入15mL质量分数为98%浓硫酸,迅速搅拌”进行如下探究;
(1)观察现象:蔗糖先变黄,再逐渐变黑,体积膨胀,形成疏松多孔的海绵状黑色物质,同时闻到刺激性气味,按压此黑色物质时,感觉较硬,放在水中呈漂浮状态,同学们由上述现象推测出下列结论:
①浓硫酸具有强氧化性 ②浓硫酸具有吸水性 ③浓硫酸具有脱水性④浓硫酸具有酸性 ⑤黑色物质具有强吸附性
其中依据不充分的是_________(填序号);
(2)为了验证蔗糖与浓硫酸反应生成的气态产物,同学们设计了如下装置:
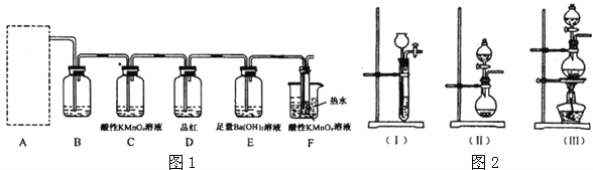
试回答下列问题:
①图1的A中最好选用下列装置_________(填编号);
②图1的 B装置所装试剂是_________;D装置中试剂的作用是_________;E装置中发生的现象是_________;
③图1的A装置中使蔗糖先变黑的化学反应方程式为_________,后体积膨胀的化学方程式为:_________;
④某学生按图2进行实验时,发现D瓶品红不褪色,E装置中有气体逸出,F装置中酸性高锰酸钾溶液颜色变浅,推测F装置中酸性高锰酸钾溶液颜色变浅的原因_________,其反应的离子方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填些对应的化学符号
(1)质量数为37的氯原子符号为________。
(2)S2-的结构示意图________。
(3) N2的电子式________
(4)磷原子的核外电子排布式__________铬原子价电子排布图_____________
(5)A元素基态原子的最外层有2个未成对电子,次外层有2个电子,其元素符号为__________。
(6)B元素的正三价离子的3d能级为半充满,其基态原子的电子排布式为___________
(7)O、N、F 3种元素的第一电离能由大到小的顺序为________(用元素符号表示)
(8)前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有1个,并且A-和B+的电子数相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2。四种元素中,D元素在周期表中的位置____第一电离能最小的是_____(填元素符号,下同),电负性最大的是______
(9)已知和碳元素同主族的X元素位于周期表中的第1个长周期,短周期元素Y原子的最外层电子数比内层电子总数少3,它们形成的化学式为XY4的物质。试回答:
X元素原子的基态电子排布式为__________
Y元素原子最外层电子的轨道表示式为________
若X、Y两元素电负性分别为2.1和2.85,则XY4中X与Y之间的化学键为_______(填“共价键”或“离子键”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温,将10mL浓度为![]() 的
的![]() 、
、![]() 两种一元碱溶液分别加水稀释,曲线如图,V是溶液体积(mL),
两种一元碱溶液分别加水稀释,曲线如图,V是溶液体积(mL),![]() 。已知:
。已知:![]() ;
;![]() 。下列说法正确的是( )
。下列说法正确的是( )
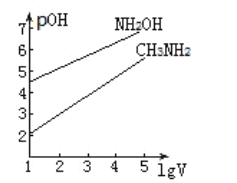
A.该温度下,![]() 的数量级为
的数量级为![]()
B.当![]() 时,水的电离程度:
时,水的电离程度:![]()
C.用等浓度盐酸分别滴定两种碱溶液至![]() ,消耗盐酸的体积:
,消耗盐酸的体积:![]()
D.等浓度的![]() 和
和![]() 两种盐溶液中离子总浓度相等
两种盐溶液中离子总浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第Ⅷ族元素![]() 、
、![]() 、
、![]() 性质相似,称为铁系元素,主要用于制造合金。回答下列问题:
性质相似,称为铁系元素,主要用于制造合金。回答下列问题:
(1)基态![]() 原子核外能量最高的电子位于_______能级,同周期元素中,基态原子未成对电子数与
原子核外能量最高的电子位于_______能级,同周期元素中,基态原子未成对电子数与![]() 相同的元素名称为______________。
相同的元素名称为______________。
(2)![]() 与酚类物质的显色反应常用于其离子检验,已知
与酚类物质的显色反应常用于其离子检验,已知![]() 遇邻苯二酚(
遇邻苯二酚(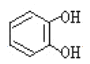 )和对苯二酚(
)和对苯二酚(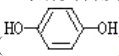 )均显绿色。邻苯二酚的熔沸点比对苯二酚_____(填“高”或“低”),原因是_________。
)均显绿色。邻苯二酚的熔沸点比对苯二酚_____(填“高”或“低”),原因是_________。
(3)有历史记载的第一个配合物是![]() (普鲁士蓝),该配合物的内界为__________。表为
(普鲁士蓝),该配合物的内界为__________。表为![]() 、
、![]() 不同配位数时对应的晶体场稳定化能(可衡量形成配合物时,总能量的降低)。由表可知,
不同配位数时对应的晶体场稳定化能(可衡量形成配合物时,总能量的降低)。由表可知,![]() 比较稳定的配离子配位数是__________(填“4”或“6”)。
比较稳定的配离子配位数是__________(填“4”或“6”)。![]() 性质活泼,易被还原,但
性质活泼,易被还原,但![]() 很稳定,可能的原因是________________。
很稳定,可能的原因是________________。
离子 | 配位数 | 晶体场稳定化能(Dq) |
| 6 | -8Dq+2p |
4 | -5.34Dq+2p | |
| 6 | -12Dq+3p |
4 | -3.56Dq+3p |
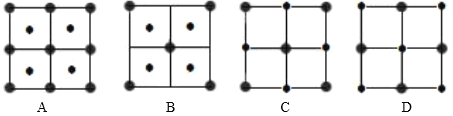
(4)![]() 晶体结构中阴阳离子的配位数均为6,则晶胞的俯视图可能是_______(填选项字母)。若晶胞参数为apm,阿伏加德罗常数的值为
晶体结构中阴阳离子的配位数均为6,则晶胞的俯视图可能是_______(填选项字母)。若晶胞参数为apm,阿伏加德罗常数的值为![]() ,晶体的密度是________
,晶体的密度是________![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从铜氨废液含[Cu(NH3)3·CO]+、[Cu(NH3)2]2+、[Cu(NH3)4]2+、NH3、CH3COO-、CO32-等中回收铜的工艺流程如图:

(1)步骤(Ⅰ)“吹脱”的目的是___(写一条即可);由步骤(Ⅱ)可确定NH3与H+的结合能力比与Cu2+的___(填“强”或“弱”)。
(2)步骤(Ⅲ)“沉铜”时,Na2S的用量比理论用量多,目的是___。
(3)步骤(Ⅳ)反应中,氧化产物与还原产物的物质的量之比为___。
(4)步骤(Ⅵ)发生反应生成难溶Cu2(OH)3Cl的离子方程式为___,pH与铜的回收率关系如图(a)所示,为尽可能提高铜的回收率,需控制的pH约为___。
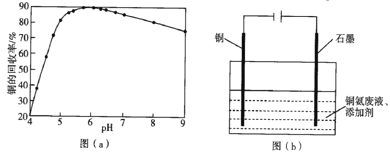
(5)“吹脱”后的铜氨溶液中加入适量的添加剂可直接电解回收金属铜,装置如图(b)所示,阴极主要发生的电极方程式为___;添加NaCl和H2SO4均可提高电导率和电流效率,从而提高铜的回收率,从环境角度考虑,较好的是___(填“NaCl”或“H2SO4”)。
(6)已知上述流程中只有步骤(Ⅲ)“沉铜”和步骤Ⅴ“制硫酸铜”中铜元素有损耗。步骤(Ⅲ)“沉铜”时铜元素的损耗率为4%;步骤Ⅴ“制硫酸铜”时铜元素损耗率为2%。若1L废液最终制得CuSO45H2O375g,则1L废液中含有铜元素的质量为___g。(保留整数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1 molL1NaOH溶液500mL和0.5 molL1硫酸溶液480mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是______(填序号),配制上述溶液还需用到的玻璃仪器有玻璃棒和______(填仪器名称)。
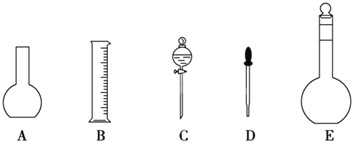
(2)容量瓶使用前必须进行的一步操作是___________。
(3)根据计算,该实验用托盘天平称取NaOH的质量为______g。在实验中其他操作均正确,若称量NaOH溶液时砝码生锈,则所得溶液浓度______0.1molL1(填“大于”“等于”或“小于”,下同)。若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度______0.1molL1。
(4)在配制稀H2SO4的过程中,下列情况对硫酸溶液物质的量浓度有何影响(填“偏高”“偏低”或“无影响”)?
①未经冷却趁热将溶液注入容量瓶中:___________。
②定容时仰视观察液面:___________。
③用量筒量取浓硫酸时俯视:______________。
(5)在实验过程中出现如下情况应如何处理?
加蒸馏水时不慎超过了刻度,应_________;加蒸馏水到刻度下1cm ~ 2 cm处应__________滴加至凹液面最低处与刻度线相切;移液时不慎将少量液滴滴在容量瓶外面,应_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】洛匹那韦(Lopinavir)是抗艾滋病毒常用药,在“众志成城战疫情”中,洛匹那韦,利托那韦合剂被用于抗新型冠状病毒(2019-nCoV)。洛匹那韦的合成路线可设计如图:

回答下列问题:
(1)A的化学名称是_______;A制备B反应的化学方程式为_________(注明反应条件)。
(2)D生成E的反应类型为_____;F中能与氢气发生加成反应的官能团名称为___。
(3)C的分子式为_____;一定条件下,C能发生缩聚反应,化学方程式为_____。
(4)K2CO3具有碱性,其在制备D的反应中可能的作用是______。
(5)X是C的同分异构体,写出一种符合下列条件的X的结构简式______。
①含有苯环,且苯环上的取代基数目≤2
②含有硝基
③有四种不同化学环境的氢,个数比为6:2:2:1
(6)已知:CH3COOH![]() CH3COCl,(2,6-二甲基苯氧基)乙酰氯(
CH3COCl,(2,6-二甲基苯氧基)乙酰氯( )是由G合成洛匹那韦的原料之一,写出以2,6-二甲基苯酚、ClCH2COOCH2CH3、K2CO3为原料制各该物质的合成路线________(其它无机试剂任选)。
)是由G合成洛匹那韦的原料之一,写出以2,6-二甲基苯酚、ClCH2COOCH2CH3、K2CO3为原料制各该物质的合成路线________(其它无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有NaCl、Na2SO4和NaNO3的混合溶液,选择适当的试剂将其转化为相应的沉淀或固体,从而实现氯离子(Cl-)、硫酸根离子(SO42-)和硝酸根离子(NO3-)的相互分离,实验过程如下:
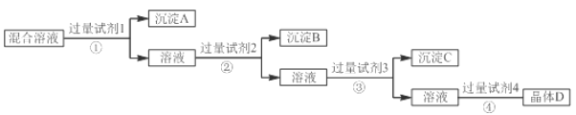
试剂3:Na2CO3;试剂4:硝酸
请回答下列问题:
(1)写出试剂②的名称______________。
(2)写出过量Na2CO3的目的是___________________________________________________。
(3)写出混合溶液D与过量硝酸反应的化学方程式:________________________________。
(4)写出操作④的名称______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com