
【题目】从铜氨废液含[Cu(NH3)3·CO]+、[Cu(NH3)2]2+、[Cu(NH3)4]2+、NH3、CH3COO-、CO32-等中回收铜的工艺流程如图:

(1)步骤(Ⅰ)“吹脱”的目的是___(写一条即可);由步骤(Ⅱ)可确定NH3与H+的结合能力比与Cu2+的___(填“强”或“弱”)。
(2)步骤(Ⅲ)“沉铜”时,Na2S的用量比理论用量多,目的是___。
(3)步骤(Ⅳ)反应中,氧化产物与还原产物的物质的量之比为___。
(4)步骤(Ⅵ)发生反应生成难溶Cu2(OH)3Cl的离子方程式为___,pH与铜的回收率关系如图(a)所示,为尽可能提高铜的回收率,需控制的pH约为___。
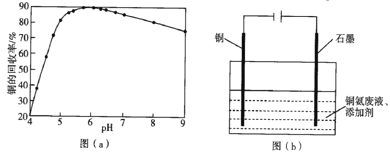
(5)“吹脱”后的铜氨溶液中加入适量的添加剂可直接电解回收金属铜,装置如图(b)所示,阴极主要发生的电极方程式为___;添加NaCl和H2SO4均可提高电导率和电流效率,从而提高铜的回收率,从环境角度考虑,较好的是___(填“NaCl”或“H2SO4”)。
(6)已知上述流程中只有步骤(Ⅲ)“沉铜”和步骤Ⅴ“制硫酸铜”中铜元素有损耗。步骤(Ⅲ)“沉铜”时铜元素的损耗率为4%;步骤Ⅴ“制硫酸铜”时铜元素损耗率为2%。若1L废液最终制得CuSO45H2O375g,则1L废液中含有铜元素的质量为___g。(保留整数)
【答案】将Cu(Ⅰ)氧化为Cu(Ⅱ)、将CO氧化并以CO2吹出、吹出游离的NH3等 强 使Cu2+尽可能沉淀完全,降低残留率 3:2 2[Cu(NH3)4]2++Cl+5H++3H2O=Cu2(OH)3Cl↓+8NH4+ 6(或5.56.5) [Cu(NH3)4]2++2e=Cu+4NH3 H2SO4 102
【解析】
从铜氨废液含[Cu(NH3)3·CO]+、[Cu(NH3)2]2+、[Cu(NH3)4]2+、NH3、CH3COO-、CO32-等中回收铜,废液中通入热空气,并加热,可生成二氧化碳、氨气,得到含有[Cu(NH3)4]2+、CH3COO-、CO32-的溶液,加入20%的硫酸,调节pH=2,得到硫酸铜、硫酸铵溶液,加入20%的硫化钠溶液生成CuS沉淀,在沉淀中加入硝酸可生成NO、S和硝酸铜,加入硫酸生成硫酸铜,经蒸发晶体得到无水硫酸铜晶体;[Cu(NH3)4]2+、CH3COO-、CO32-的溶液加入盐酸,经过滤、洗涤、干燥,可得到碱式氯化铜,以此解答该题。
(1)步骤(Ⅰ)“吹脱”时通入空气,氧气可将Cu(Ⅰ)氧化为Cu(Ⅱ)、将CO氧化生成CO2吹出、吹出游离的NH3等,步骤(Ⅱ)加入硫酸生成硫酸铵,可确定NH3与H+的结合能力比与Cu2+的强,故答案为:将Cu(Ⅰ)氧化为Cu(Ⅱ)、将CO氧化并以CO2吹出、吹出游离的NH3等;强;
(2)步骤(Ⅲ)“沉铜”时,Na2S的用量比理论用量多,可使Cu2+尽可能生成CuS沉淀,可降低残留率,故答案为:使Cu2+尽可能沉淀完全,降低残留率;
(3)CuS与硝酸反应生成NO、S,反应中S元素化合价由2价升高到0价,N元素化合价由+5价降低为+2价,则氧化产物与还原产物的物质的量之比为3:2,故答案为:3:2;
(4)步骤(Ⅵ)发生反应生成难溶Cu2(OH)3Cl的离子方程式为2[Cu(NH3)4]2++Cl+5H++3H2O=Cu2(OH)3Cl↓+8NH4+,由图可知为尽可能提高铜的回收率,需控制的pH约为6(或5.56.5),故答案为:2[Cu(NH3)4]2++Cl+5H++3H2O=Cu2(OH)3Cl↓+8NH4+;6(或5.56.5);
(5)阴极主要发生反应的电极反应式为[Cu(NH3)4]2++2e=Cu+4NH3,如加入盐酸,则阳极发生氧化反应生成氯气,污染空气,从环保的角度可知,应加入硫酸,故答案为:[Cu(NH3)4]2++2e=Cu+4NH3;H2SO4;
(6)375gCuSO45H2O中Cu的质量=375g×![]() ÷(12%)÷(14%)=102g,故答案为:102。
÷(12%)÷(14%)=102g,故答案为:102。


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
【题目】现用固体KOH配制0.1mol/L 的KOH溶液 480mL,回答下列问题:
(1)配制过程中需要用到的玻璃仪器有烧杯,玻璃棒,量筒,胶头滴管,____________。
(2)需要用托盘天平称量_______gKOH固体。
(3)如果在定容时仰视操作,则所配得溶液的浓度_____0.1mol/L(填> , = , <)容量瓶不干燥,有一定的水分,则所配得溶液的浓度_____0.1mol/L(填> , = , <)
(4)若所用的固体KOH中混有NaOH,则所配得溶液的c(OH-)浓度______0.1mol/L (填> , = , <)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对氧化还原反应的分析中合理的是
A.Mg变为MgO时化合价升高,因此,Mg在该反应中作还原剂
B.KMnO4受热分解时,Mn元素化合价一方面升高一方面降低,因此,在该反应中Mn元 素既被氧化又被还原
C.凡是氧化还原反应都能造福人类
D.在反应2H2O![]() 2H2↑+ O2↑中H2O是还原剂
2H2↑+ O2↑中H2O是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子化合物G( )是一种重要的合成聚酯纤维,其合成路线如下:
)是一种重要的合成聚酯纤维,其合成路线如下:

已知:
① +
+ +R2OH
+R2OH
② +R3OH
+R3OH![]()
 +R2OH
+R2OH
(1)F的结构简式为_______________,①的反应类型为______________,E中官能团名称为______________,⑤的反应方程式为______________。
(2)写出符合下列条件E的同分异构体______________(填结构简式,不考虑立体异构)。
①含有苯环,遇![]() 溶液不变色
溶液不变色
②能发生银镜反应
③核磁共振氢光谱图峰面积之比为1:3:6:6
(3)判断化合物E中有无手性碳原子,若有,用“*”标出_________。
(4)写出以1,3-丙二醇和甲醇为原料制备 的合成路线(其它试剂任选)___________
的合成路线(其它试剂任选)___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程的离子方程式书写正确的是( )
A.Cu与AgNO3溶液反应: Cu + Ag+![]() Ag + Cu2+
Ag + Cu2+
B.醋酸与氢氧化钠溶液反应: CH3COOH + OH![]() CH3COO + H2O
CH3COO + H2O
C.碳酸氢钠与硫酸反应: CO32 + 2H+![]() CO2↑ + H2O
CO2↑ + H2O
D.氢氧化铁胶体的制备:Fe2+ + 3H2O ![]() Fe(OH)3↓ + 3H+
Fe(OH)3↓ + 3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸的反应为:S+2KNO3+3C![]() K2S+N2↑+3CO2↑,下列说法中正确的是( )
K2S+N2↑+3CO2↑,下列说法中正确的是( )
A.该反应中的还原剂为KNO3
B.该反应中C被还原
C.若消耗32g S,该反应转移电子数为4 NA
D.若生成标准状况下气体22.4L,则有0.75 mol物质被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳元素的单质有多种形式,下图依次是C60、石墨和金刚石的结构图:

回答下列问题:
(1)金刚石、石墨、C60、碳纳米管等都是碳元素的单质形式,它们互为_________。
(2)金刚石、石墨烯(指单层石墨)中碳原子的杂化形式分别为________、________。
(3)C60属于_________晶体,石墨属于________晶体。
(4)石墨晶体中,层内C—C键的键长为142 pm,而金刚石中C—C键的键长为154 pm,其原因是金刚石中只存在C—C间的________共价键,而石墨层内的C—C间不仅存在_________共价键,还有_________键。
(5)金刚石晶胞含有________个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r=________a,列式表示碳原子在晶胞中的空间占有率________(用含π分数形式表示,不要求写成百分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家在利用无土栽培法培养一些名贵花卉时,培养液中添加了多种必需化学元素。其配方如下:
离子 |
|
|
|
|
|
|
|
|
培养液浓度 | 1 | 1 | 0.25 | 1 | 2 | 1 | 0.25 | 1 |
其中花卉根细胞吸收最少的离子是( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,国家电投集团正在建设国内首座百千瓦级铁-铬液流电池储能示范电站。铁-铬液流电池总反应为Fe3++Cr2+![]() Fe2++Cr3+,工作示意图如图。下列说法错误的是
Fe2++Cr3+,工作示意图如图。下列说法错误的是

A.放电时a电极反应为Fe 3++e=Fe2+
B.充电时b电极反应为Cr3++e=Cr2+
C.放电过程中H+通过隔膜从正极区移向负极区
D.该电池无爆炸可能,安全性高,毒性和腐蚀性相对较低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com