
【题目】高分子化合物G( )是一种重要的合成聚酯纤维,其合成路线如下:
)是一种重要的合成聚酯纤维,其合成路线如下:

已知:
① +
+ +R2OH
+R2OH
② +R3OH
+R3OH![]()
 +R2OH
+R2OH
(1)F的结构简式为_______________,①的反应类型为______________,E中官能团名称为______________,⑤的反应方程式为______________。
(2)写出符合下列条件E的同分异构体______________(填结构简式,不考虑立体异构)。
①含有苯环,遇![]() 溶液不变色
溶液不变色
②能发生银镜反应
③核磁共振氢光谱图峰面积之比为1:3:6:6
(3)判断化合物E中有无手性碳原子,若有,用“*”标出_________。
(4)写出以1,3-丙二醇和甲醇为原料制备 的合成路线(其它试剂任选)___________
的合成路线(其它试剂任选)___________
【答案】![]() 加成反应 酯基、羧基
加成反应 酯基、羧基 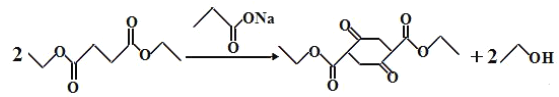
![]()
![]()
![]()
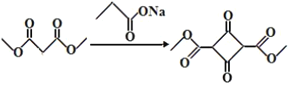
【解析】
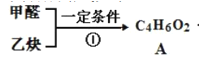 ,由碳原子数和氧原子数可知,1份乙炔和2份甲醛反应,由于A中碳、氢、氧数目为1份乙炔和2份甲醛之和,故反应①为加成,A的结构为OHC-CH2-CH2-CHO;
,由碳原子数和氧原子数可知,1份乙炔和2份甲醛反应,由于A中碳、氢、氧数目为1份乙炔和2份甲醛之和,故反应①为加成,A的结构为OHC-CH2-CH2-CHO;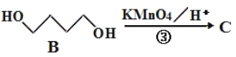 ,二元醇被氧化为二元羧酸,C为HOOC-CH2-CH2-COOH;C转化为D是C与
,二元醇被氧化为二元羧酸,C为HOOC-CH2-CH2-COOH;C转化为D是C与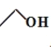 发生1:1的酯化反应形成
发生1:1的酯化反应形成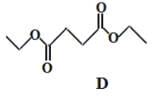 ;根据已知信息①,D到E发生反应为
;根据已知信息①,D到E发生反应为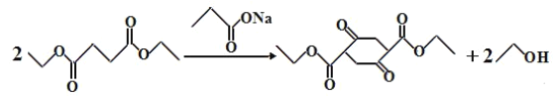 ,最后
,最后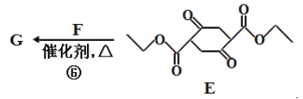 发生了已知信息②的反应,F为
发生了已知信息②的反应,F为
![]() 。
。
(1)根据分析,F为![]() ;
;  ,由碳原子数和氧原子数可知,1份乙炔和2份甲醛反应,由于A中碳、氢、氧数目为1份乙炔和2份甲醛之和,故反应①为加成反应;E的结构为
,由碳原子数和氧原子数可知,1份乙炔和2份甲醛反应,由于A中碳、氢、氧数目为1份乙炔和2份甲醛之和,故反应①为加成反应;E的结构为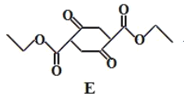 ,其中的官能团名称为酯基、羧基;根据已知反应①,2份
,其中的官能团名称为酯基、羧基;根据已知反应①,2份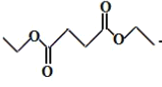 在
在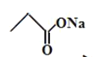 的条件下,发生成环反应,形成E和2份的
的条件下,发生成环反应,形成E和2份的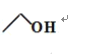 故答案为:
故答案为:
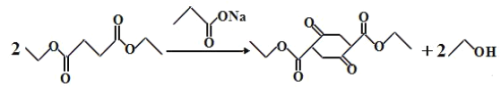 ;
;
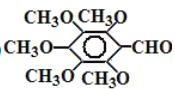
(2) E的分子式为C12H16O6, 符合下列条件E的同分异构体:①含有苯环,遇![]() 溶液不变色说明其不含酚羟基;②能发生银镜反应,则其含醛基;③核磁共振氢光谱图峰面积之比为1:3:6:6,说明有四种氢,且数目分别为1、3、6、6,再根据E的不饱和度为
溶液不变色说明其不含酚羟基;②能发生银镜反应,则其含醛基;③核磁共振氢光谱图峰面积之比为1:3:6:6,说明有四种氢,且数目分别为1、3、6、6,再根据E的不饱和度为![]() =5,而苯环、醛基不饱和度已经符合,那么O只能形成醚键,因此,符合条件的为
=5,而苯环、醛基不饱和度已经符合,那么O只能形成醚键,因此,符合条件的为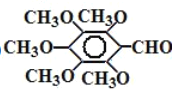 ;
;
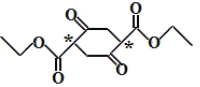
(3) 手性碳原子指的是碳原子上连接4个不同的原子团,E中存在手性碳,用星号标记为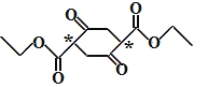 ;
;
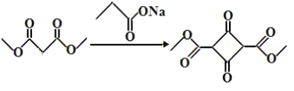
(4) 1,3-丙二醇和甲醇为原料制备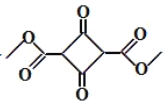 ,采用逆推法,根据已知反应①,先要制取
,采用逆推法,根据已知反应①,先要制取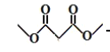 ,而
,而 可通过
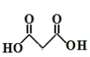
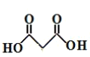
可通过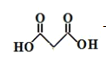 与2份甲醇酯化得到,1,3-丙二醇在酸性高锰酸钾的条件下,可氧化成
与2份甲醇酯化得到,1,3-丙二醇在酸性高锰酸钾的条件下,可氧化成 ,故答案为:
,故答案为:![]()
![]()
![]()
 。
。


科目:高中化学 来源: 题型:
【题目】用黄铜矿(主要成分是CuFeS2)生产粗铜的反应原理如下:

(1)已知在反应①、②中均生成相同的气体分子,该气体具有漂白性。请分别写出反应①、②的化学方程式是___________________、__________________。
(2)基态铜原子的核外电子排布式为________,硫、氧元素相比,第一电离能较大的是________。
(3)反应①和②生成的气体分子的中心原子的杂化类型是________,分子的空间构型是________。
(4)某学生用硫酸铜溶液与氨水做了一组实验,CuSO4溶液中加氨水生成蓝色沉淀,再加氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体,请解释加入乙醇后析出晶体的原因_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】120mL含有0.20mol碳酸钠的溶液和200mL盐酸,不管将前者滴入后者,还是将后者滴入前者,都有气体产生,但最终生成的气体体积不同,且比值为5:2,则盐酸的浓度是( )
A.2.0mol/LB.1.0mol/LC.0.18mol/LD.1.25mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜为白色粉末状固体,难溶于水和乙醇,潮湿时易被氧化,可用作催化剂、杀菌剂、媒染剂等。工业以硫化铜精矿为原料,制备氯化亚铜的流程如图:
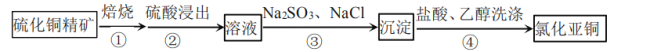
下列说法正确的是( )
A.步骤①焙烧产生的有毒气体可用碱液吸收
B.步骤②所用硫酸浓度越大浸出速率越快
C.步骤③离子方程式:![]()
D.步骤④用乙醇洗涤的目的是使![]() 尽快干燥,防止被空气氧化
尽快干燥,防止被空气氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温,将10mL浓度为![]() 的
的![]() 、
、![]() 两种一元碱溶液分别加水稀释,曲线如图,V是溶液体积(mL),
两种一元碱溶液分别加水稀释,曲线如图,V是溶液体积(mL),![]() 。已知:
。已知:![]() ;
;![]() 。下列说法正确的是( )
。下列说法正确的是( )
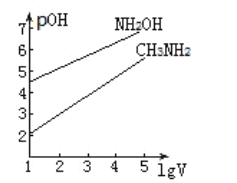
A.该温度下,![]() 的数量级为
的数量级为![]()
B.当![]() 时,水的电离程度:
时,水的电离程度:![]()
C.用等浓度盐酸分别滴定两种碱溶液至![]() ,消耗盐酸的体积:
,消耗盐酸的体积:![]()
D.等浓度的![]() 和
和![]() 两种盐溶液中离子总浓度相等
两种盐溶液中离子总浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A. 常温常压下,11.2L氧气所含的原子数为NA
B. 1.8g的NH4+离子中含有的质子数为NA
C. 常温常压下,46gNO2含有的原子总数为3NA
D. 标况下,4.48LH2O中含有氢原子数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从铜氨废液含[Cu(NH3)3·CO]+、[Cu(NH3)2]2+、[Cu(NH3)4]2+、NH3、CH3COO-、CO32-等中回收铜的工艺流程如图:

(1)步骤(Ⅰ)“吹脱”的目的是___(写一条即可);由步骤(Ⅱ)可确定NH3与H+的结合能力比与Cu2+的___(填“强”或“弱”)。
(2)步骤(Ⅲ)“沉铜”时,Na2S的用量比理论用量多,目的是___。
(3)步骤(Ⅳ)反应中,氧化产物与还原产物的物质的量之比为___。
(4)步骤(Ⅵ)发生反应生成难溶Cu2(OH)3Cl的离子方程式为___,pH与铜的回收率关系如图(a)所示,为尽可能提高铜的回收率,需控制的pH约为___。
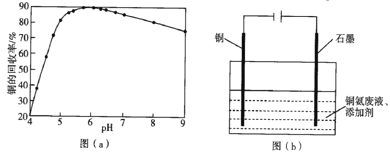
(5)“吹脱”后的铜氨溶液中加入适量的添加剂可直接电解回收金属铜,装置如图(b)所示,阴极主要发生的电极方程式为___;添加NaCl和H2SO4均可提高电导率和电流效率,从而提高铜的回收率,从环境角度考虑,较好的是___(填“NaCl”或“H2SO4”)。
(6)已知上述流程中只有步骤(Ⅲ)“沉铜”和步骤Ⅴ“制硫酸铜”中铜元素有损耗。步骤(Ⅲ)“沉铜”时铜元素的损耗率为4%;步骤Ⅴ“制硫酸铜”时铜元素损耗率为2%。若1L废液最终制得CuSO45H2O375g,则1L废液中含有铜元素的质量为___g。(保留整数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是( )
A. 标准状况下,22.4L H2O含有的分子数为1 NA
B. 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA
C. 常温常压下,1 NA 个CO2分子占有的体积为22.4L
D. 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为1 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在粗食盐中除泥沙外,还含Na2SO4、MgCl2、CaCl2等杂质,工业制精盐除杂时,常常加入过量的除杂剂,现提供下列试剂:a.NaOH溶液;b.盐酸;c.BaCl2溶液;d.Na2CO3溶液,则加入试剂和操作不正确的是( )
A.粗盐![]() 粗盐水
粗盐水![]()
![]()
![]() 滤液
滤液![]() 精盐
精盐
B.粗盐![]() 粗盐水
粗盐水![]()
![]()
![]() 滤液
滤液![]() 精盐
精盐
C.粗盐![]() 粗盐水
粗盐水![]()
![]()
![]() 滤液
滤液![]() 精盐
精盐
D.粗盐![]() 粗盐水
粗盐水![]()
![]()
![]() 滤液
滤液![]() 精盐
精盐
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com