
【题目】用黄铜矿(主要成分是CuFeS2)生产粗铜的反应原理如下:

(1)已知在反应①、②中均生成相同的气体分子,该气体具有漂白性。请分别写出反应①、②的化学方程式是___________________、__________________。
(2)基态铜原子的核外电子排布式为________,硫、氧元素相比,第一电离能较大的是________。
(3)反应①和②生成的气体分子的中心原子的杂化类型是________,分子的空间构型是________。
(4)某学生用硫酸铜溶液与氨水做了一组实验,CuSO4溶液中加氨水生成蓝色沉淀,再加氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体,请解释加入乙醇后析出晶体的原因_______________。
【答案】2Cu2S+3O2![]() 2Cu2O+2SO2 2Cu2O+Cu2S
2Cu2O+2SO2 2Cu2O+Cu2S![]() 6Cu+SO2↑ 1s22s22p63s23d104s1或[Ar]3d104s1 氧 sp2 V型 乙醇分子极性比水分子极性弱,加入乙醇降低溶剂的极性,从而减小溶质的溶解度
6Cu+SO2↑ 1s22s22p63s23d104s1或[Ar]3d104s1 氧 sp2 V型 乙醇分子极性比水分子极性弱,加入乙醇降低溶剂的极性,从而减小溶质的溶解度
【解析】
(1)由题给信息知反应①是Cu2S和O2反应生成Cu2O的反应,由于Cu元素的化合价不变,O元素的化合价降低,则S元素的化合价一定升高,结合所学知识知道生成的物质为SO2;反应②是Cu2O和Cu2S反应生成Cu的反应,Cu元素的化合价降低,元素S的化合价升高生成SO2,根据电子守恒、原子守恒配平化学方程式即可;
(2)Cu是29号元素,根据核外电子排布规律书写铜的基态原子价电子排布式;
同一主族的元素,元素的非金属性越强,其第一电离能越大;
(3)由(1)分析知反应①②生成的相同气体分子是SO2,根据价层电子对数及含有的孤电子对判断其空间构型、中心原子的杂化方式;
(4)[Cu(NH3)4]SO4在乙醇中的溶解度小于在水中的溶解度,向溶液中加入乙醇后会析出蓝色晶体[Cu(NH3)4]SO4。
(1)由题给信息知反应①是Cu2S和O2反应生成Cu2O的反应,由于Cu元素的化合价不变,O元素的化合价降低,则S元素的化合价一定升高,结合所学知识知道生成的物质为SO2;反应②是Cu2O和Cu2S反应生成Cu的反应,Cu元素的化合价降低,元素S的化合价升高生成SO2,根据电子守恒、原子守恒,可得反应的化学方程式分别是:2Cu2S+3O2![]() 2Cu2O+2SO2;2Cu2O+Cu2S
2Cu2O+2SO2;2Cu2O+Cu2S![]() 6Cu+SO2↑;
6Cu+SO2↑;
(2)Cu是29号元素,原子核外电子数为29,根据构造原理可得基态Cu原子的核外电子排布式为1s22s22p63s23p63d104s1或写为[Ar]3d104s1;同一主族的元素,元素的非金属性越强,其第一电离能越大。由于元素的非金属性O>S,所以第一电离能较大的是氧;
(3)由(1)分析知反应①②生成的相同气体分子是SO2,SO2中中心S原子的价层电子对数为:2+![]() =3,且S原子上含有一对孤电子对,所以SO2分子的空间构型是V型、中心原子的杂化方式为sp2杂化;
=3,且S原子上含有一对孤电子对,所以SO2分子的空间构型是V型、中心原子的杂化方式为sp2杂化;
(4)向CuSO4溶液中加氨水生成Cu(OH)2蓝色沉淀和(NH4)2SO4,再向其中加入过量氨水,Cu(OH)2与一水合氨反应产生[Cu(NH3)4]2+,使沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体,这是由于[Cu(NH3)4]SO4·H2O是离子化合物,水是由极性分子构成的溶剂,而乙醇分子的极性相对水来说较小,从而减小溶质的溶解度,因此在乙醇中的溶解度小于在水中的溶解度,则会析出深蓝色的晶体[Cu(NH3)4]SO4·H2O晶体。


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
【题目】意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的气态N4分子,其分子结构如图所示。已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,判断下列说法正确的是( )
A. N4属于一种新型的化合物
B. N4是N2的同素异形体
C. N4分子中N-N键角为109°28′
D. 1mol N4转变成N2将吸收882 kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁(Fe)、铜(Cu)、银(Ag)是常见的金属元素,它们的单质及其化合物在生活中有广泛应用。
(1)Ag 与 Cu 在同一族,则 Ag 在周期表中________ (填“s”、“p”、“d”或“ds”)区;[Ag(NH3)2]+中 Ag+空的 5s 轨道和 5p 轨道以sp 杂化成键,则该配离子的空间构型是________。
(2)基态 Cu+的简化电子排布式为________。
(3)表中是 Fe 和 Cu 的部分电离能数据:请解释 I2(Cu)大于 I2(Fe)的主要原因:________。
元素 | Fe | Cu |
第一电离能 I1/kJ·mol-1 | 759 | 746 |
第二电离能 I2/kJ·mol-1 | 1561 | 1958 |
(4)亚铁氰化钾是食盐中常用的抗结剂,其化学式为 K4[Fe(CN)6]。
①CN-的电子式是________;1mol 该配离子中含σ 键数目为________。
②该配合物中存在的作用力类型有________ (填字母)。
A.金属键 B.离子键 C.共价键 D.配位键 E.氢键 F.范德华力
(5)氧化亚铁晶体的晶胞结构如图所示。已知:
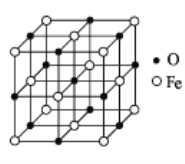
氧化亚铁晶体的密度为 ρgcm﹣3,NA代表阿伏加德罗常数的值。在该晶胞中,与 Fe2+紧邻且等距离的 Fe2+数目为________,Fe2+与O2﹣最短核间距为________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)SO2和SO3是硫的两种氧化物,等温等压下,等质量的SO2和SO3所含分子个数比为________,氧原子个数比为________,等温等压下气体体积比_____________。
(2)100mL的某气体的质量为0.143g,该气体的相对分子质量:______________,
(3)设NA为阿伏加德罗常数的数值,如果ag某气体中含有的分子数为b,则cg该气体在标准状况下的体积约是___________L(用含NA的式子表示)。
(4)配制100 mL1 mol/L的H2SO4溶液,需要用量筒量取浓H2SO4(密度为1.84g·mL-1,质量分数为98%)的体积为__________mL。
(5)10.6gNa2CO3溶于水,配成500mL的溶液,溶液中溶质的物质的量________,Na+的物质的量浓度______________。
(6)标准状况下,5.6LNH3中氢原子的数目为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室制取纯净、干燥的氯气,并验证氯气性质的装置。其中E瓶放有干燥红色布条;F中为红色的铜网,其右端出气管口放有脱脂棉。

(1)装置C中盛装的溶液是____________,D中试剂的作用是________。
(2)E中的红色布条是否退色?____,写出F中反应的化学反应方程式:____,其反应现象为_____________。
(3)新制氯水呈黄绿色说明其中含有_____,(填化学式,下同),将紫色石蕊溶液滴入可观察到的现象是_________________,说明其中含有__________。
(4)H中的试剂为___________,用来吸收多余氯气。工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白精,该反应的化学方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用固体KOH配制0.1mol/L 的KOH溶液 480mL,回答下列问题:
(1)配制过程中需要用到的玻璃仪器有烧杯,玻璃棒,量筒,胶头滴管,____________。
(2)需要用托盘天平称量_______gKOH固体。
(3)如果在定容时仰视操作,则所配得溶液的浓度_____0.1mol/L(填> , = , <)容量瓶不干燥,有一定的水分,则所配得溶液的浓度_____0.1mol/L(填> , = , <)
(4)若所用的固体KOH中混有NaOH,则所配得溶液的c(OH-)浓度______0.1mol/L (填> , = , <)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铝土矿和黄铁矿的共生矿(主要成分为Al2O3、FeS2和SiO2),由此矿石制备Fe3O4和Al2O3的流程如下图所示,回答下列问题:
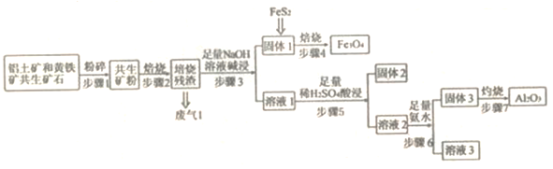
(1)“步骤2”焙烧过程产生的废气为 _________。
(2)已知“步骤4”隔绝空气焙烧,则化学方程式为________(已知该过程产生的废气和废气1成分相同)。
(3)“固体2”的成分是_________,步骤5的分离方法是_________。
(4)写出步骤5的离子方程式__________。
(5)若原矿石质量为bkg,经过该过程获得的Fe3O4的质童为akg,则原矿石中铁元素的质量分数为________。
(6)该流程中存在较为明显的缺陷是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子化合物G( )是一种重要的合成聚酯纤维,其合成路线如下:
)是一种重要的合成聚酯纤维,其合成路线如下:

已知:
① +
+ +R2OH
+R2OH
② +R3OH
+R3OH![]()
 +R2OH
+R2OH
(1)F的结构简式为_______________,①的反应类型为______________,E中官能团名称为______________,⑤的反应方程式为______________。
(2)写出符合下列条件E的同分异构体______________(填结构简式,不考虑立体异构)。
①含有苯环,遇![]() 溶液不变色
溶液不变色
②能发生银镜反应
③核磁共振氢光谱图峰面积之比为1:3:6:6
(3)判断化合物E中有无手性碳原子,若有,用“*”标出_________。
(4)写出以1,3-丙二醇和甲醇为原料制备 的合成路线(其它试剂任选)___________
的合成路线(其它试剂任选)___________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com