
【题目】意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的气态N4分子,其分子结构如图所示。已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,判断下列说法正确的是( )
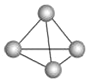
A. N4属于一种新型的化合物
B. N4是N2的同素异形体
C. N4分子中N-N键角为109°28′
D. 1mol N4转变成N2将吸收882 kJ热量
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
【题目】下列过程所发生的反应属于离子反应的是( )
A.H2O2分解制取O2
B.H2和O2反应生成水
C.加热分解KMnO4制氧气
D.氧化镁投入稀盐酸中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲用98%的浓硫酸(g=1.84g·cm-3)配制成浓度为0.5mol·L-1的稀硫酸500ml。
(1)选用的主要仪器有:
①__________,②__________,③__________,④____________,⑤____________。
(2)请将下列各操作,按正确的序号填在横线上。
A.用量筒量取浓H2SO4 |
B.反复颠倒摇匀 |
C.用胶头滴管加蒸馏水至刻度线 |
D.洗净所用仪器 |
E.稀释浓H2SO4
F.将溶液转入容量瓶
其操作正确的顺序依次为______________________。
(3)简要回答下列问题:
①所需浓硫酸的体积为____________mL。
②如果实验室有15mL、20mL、50mL的量筒应选用____________mL的量筒最好,量取时发现量筒不干净用水洗净后直接量取将使浓度__________(“偏高”、“偏低”、“无影响”)
③将浓硫酸沿烧杯内壁慢慢注入盛水的烧杯中,并用玻璃棒不断搅拌的目的是____________,若搅拌过程中有液体溅出结果会使浓度偏____________。
④在转入容量瓶前烧杯中液体应____________,否则会使浓度偏____________;并洗涤烧杯和玻璃棒2~3次,洗涤液也要转入容量瓶,否则会使浓度____________。
⑤定容时必须使溶液凹液面与刻度线相切,若俯视会使浓度____________;仰视则使浓度___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是重要的工业原料,铀浓缩一直为国际社会关注。下列说法正确的是
是重要的工业原料,铀浓缩一直为国际社会关注。下列说法正确的是
A. ![]() 原子核中含有92个中子 B.
原子核中含有92个中子 B. ![]() 原子核外有143个电子
原子核外有143个电子
C. ![]() 与
与![]() 互为同位素 D.
互为同位素 D. ![]() 与
与![]() 为同一核素
为同一核素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图表示的一些物质或概念间的从属关系中正确的是
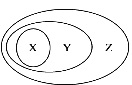
X | Y | Z | |
A | 水 | 单质 | 纯净物 |
B | 非金属氧化物 | 酸性氧化物 | 氧化物 |
C | 电解质 | 化合物 | 纯净物 |
D | 化合反应 | 氧化还原反应 | 化学反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是自然界中普遍存在的一种物质,也是维持生命活动所必需的一种物质。
信息一:水的性质存在许多反常现象,如固态密度小于液态密度使冰浮在水面上,沸点相对较高使水在常温常压下呈液态等。
信息二:在20 ℃、1个大气压下,水可以结成冰,称为“热冰”(如下图):
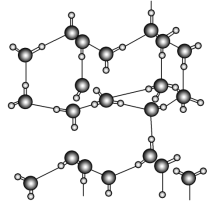
试根据以上信息回答下列问题:
(1)s轨道与s轨道重叠形成的共价键可用符号表示为ds-s,p轨道以“头碰头”方式重叠形成的共价键可用符号表示为dp-p,则H2O分子中含有的共价键用符号表示为________。
(2)下列物质熔化时,所克服的微粒间的作用与“热冰”熔化时所克服的作用类型完全相同的是________。
A 金刚石 B 干冰 C 食盐 D 固态氨
(3)已知:2H2O=H3O++OH-,H3O+的立体构型是________,H3O+中含有一种特殊的共价键是________。
(4)根据等电子原理,写出短周期元素原子形成的与H3O+互为等电子体的分子或离子________。
(5)水的分解温度远高于其沸点的原因是________________。
(6)从结构的角度分析固态水(冰)的密度小于液态水的密度的原因是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值。下列说法正确的是
A.密闭容器中,2 mol NO 和 1 mol O2 反应后分子总数为 2NA
B.标准状况下,7.8 g 乙炔和苯的混合物中含 C—H 键数目为 0.6NA
C.将 1 mol NH3 通入足量水中,NH3·H2O、NH4+粒子数目之和为 NA
D.1 L 0.1 mol·L1 FeCl3 溶液中含 Fe3+数目为 0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W五种短周期元素。X原子的质子数与电子层数相同,W原子核外电子数是M原子最外层电子数的2倍,Y、Z、M、W在周期表中的相对位置如图所示。下列说法不正确的是
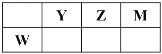
A. 原子半径:W>Y>Z>M>X
B. 热稳定性:XM>X2Z
C. 仅由X、Y、Z三种元素形成的化合物中不可能含离子键
D. WM4分子中每个原子最外层均满足8电子结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用黄铜矿(主要成分是CuFeS2)生产粗铜的反应原理如下:

(1)已知在反应①、②中均生成相同的气体分子,该气体具有漂白性。请分别写出反应①、②的化学方程式是___________________、__________________。
(2)基态铜原子的核外电子排布式为________,硫、氧元素相比,第一电离能较大的是________。
(3)反应①和②生成的气体分子的中心原子的杂化类型是________,分子的空间构型是________。
(4)某学生用硫酸铜溶液与氨水做了一组实验,CuSO4溶液中加氨水生成蓝色沉淀,再加氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体,请解释加入乙醇后析出晶体的原因_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com