
【题目】水是自然界中普遍存在的一种物质,也是维持生命活动所必需的一种物质。
信息一:水的性质存在许多反常现象,如固态密度小于液态密度使冰浮在水面上,沸点相对较高使水在常温常压下呈液态等。
信息二:在20 ℃、1个大气压下,水可以结成冰,称为“热冰”(如下图):
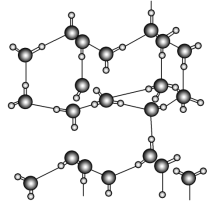
试根据以上信息回答下列问题:
(1)s轨道与s轨道重叠形成的共价键可用符号表示为ds-s,p轨道以“头碰头”方式重叠形成的共价键可用符号表示为dp-p,则H2O分子中含有的共价键用符号表示为________。
(2)下列物质熔化时,所克服的微粒间的作用与“热冰”熔化时所克服的作用类型完全相同的是________。
A 金刚石 B 干冰 C 食盐 D 固态氨
(3)已知:2H2O=H3O++OH-,H3O+的立体构型是________,H3O+中含有一种特殊的共价键是________。
(4)根据等电子原理,写出短周期元素原子形成的与H3O+互为等电子体的分子或离子________。
(5)水的分解温度远高于其沸点的原因是________________。
(6)从结构的角度分析固态水(冰)的密度小于液态水的密度的原因是_______。
【答案】ds-sp3 D 三角锥形 配位键 NH3 水分解需要破坏分子内部的极性键,水的汽化只需破坏分子间的范德华力与氢键即可,而极性键远比分子间的范德华力与氢键强得多 水分子之间除了范德华力外还存在较强的氢键,氢键是有方向性和饱和性的,水由液态变为固态时,氢键的这种方向性和饱和性表现得更为突出,每个水分子都处于与直接相邻的4个水分子构成的四面体中心,分子之间的空隙较大,密度较小
【解析】
本题考察轨道杂化类型、晶体所含的作用力、离子的空间构型、等电子体、氢键和化学键的比较。
(1)H原子只有一个电子,且占据s轨道,O原子通过杂化形成4个sp3杂化轨道,杂化轨道上有2个不成对电子,H原子的s轨道与O原子的sp3杂化轨道头碰头形成共价键,则H2O分子中含有的共价键用符号表示为ds-sp3;
(2)热冰属于分子晶体,其熔化时所克服的作用有分子间作用力和氢键;
A. 金刚石属于原子晶体,熔化需要克服共价键,A错误;
B. 干冰属于分子晶体,熔化需要克服分子间作用力,B错误;
C. 食盐属于离子晶体,熔化需要克服离子键,C错误;
D. 固态氨属于分子晶体,熔化需要克服分子间作用力和氢键,D正确;
故合理选项为D;
(3)H2O的结构本为V形,O含有两对孤电子,H+具有空轨道,可以以配位键的形式,结合其中一对孤电子形成H3O+,则该离子的空间结构为三角锥形;
(4)等电子体的要求是原子总数相同,价电子总数相同,所以短周期元素原子形成的与H3O+互为等电子体的分子或离子有NH3;
(5)水的分解温度远高于其沸点的原因是水分解需要破坏分子内部的极性键,水的汽化只需破坏分子间的范德华力与氢键即可,而极性键远比分子间的范德华力与氢键强得多;
(6)水分子之间除了范德华力外还存在较强的氢键,氢键是有方向性和饱和性的,水由液态变为固态时,氢键的这种方向性和饱和性表现得更为突出,每个水分子都处于与直接相邻的4个水分子构成的四面体中心,分子之间的空隙较大,密度较小。


科目:高中化学 来源: 题型:
【题目】(1)将等径圆球在二维空间里进行排列,可形成密置层和非密置层,在图1所示的半径相等的圆球的排列中,A属于________层,配位数是________;B属于________层,配位数是________。
(2)将非密置层一层一层地在三维空间里堆积,得到如图2所示的一种金属晶体的晶胞,它被称为简单立方堆积,在这种晶体中,金属原子的配位数是________,平均每个晶胞所占有的原子数目是________。

(3)有资料表明,只有钋的晶体中的原子具有如图2所示的堆积方式,钋位于元素周期表的第________周期第__________族,元素符号是________,最外电子层的电子排布式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300℃时,将气体X和气体Y各1.6 mol充入10 L恒容密闭容器中,发生反应:X(g) +Y(g)2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 1.2 | 1.1 | 1.0 | 1.0 |
回答下列问题:
(1)反应0~2 min Z的平均速率v(Z)=________________
(2)温度为300℃时,该反应的化学平衡常数K=____________________
(3)右图表示该反应变化过程中物质的浓度与反应的时间变化关系。图中t2→t3间的曲线变化是由于下列哪种条件的改变所引起的_______
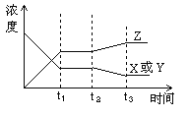
A.增大了压强 B.降低温度
C.增加了x和y的浓度 D.使用了催化剂
(4)若起始时向该容器中充入X、Y、Z各2.0 mol,则反应将向_______(填“正”或“逆”)反应方向进行,达平衡时Z的体积分数=____________,平衡时n(Y)=_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于非氧化还原反应的是
A. 2Na + Cl2 === 2NaCl B. MnO2 + 4HCl(浓) ![]() MnCl2 + Cl2↑ + 2H2O
MnCl2 + Cl2↑ + 2H2O
C. 2KI+Cl2===2KCl+I2 D. MgO+2HCl===MgCl2+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的气态N4分子,其分子结构如图所示。已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,判断下列说法正确的是( )
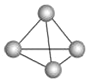
A. N4属于一种新型的化合物
B. N4是N2的同素异形体
C. N4分子中N-N键角为109°28′
D. 1mol N4转变成N2将吸收882 kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语正确的是( )
A. (NH4)2 Fe(SO4)2 溶解于水:(NH4)2 Fe(SO4)2 =NH4+ + Fe2 + + 2SO42-
B. Al(OH)3在水中的电离:Al(OH)3 ![]() Al3 ++3OH-
Al3 ++3OH-
C. H3PO4溶解于水:H3PO4 ![]() 3H+ + PO43-
3H+ + PO43-
D. NaHSO4在水中的电离:NaHSO4 = Na+ + NaHSO4-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是
A. 在25℃、101 kPa时,2 gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧热的热化学方程式为:2H2(g)+O2(g)![]() 2H2O(l);ΔH=-285.8kJ·mol-1
2H2O(l);ΔH=-285.8kJ·mol-1
B. CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)![]() 2CO(g)+O2(g);ΔH=+283.0 kJ/mol
2CO(g)+O2(g);ΔH=+283.0 kJ/mol
C. 在稀溶液中:H+(aq)+OH-(aq)= H2O(l);ΔH =-57.3 kJ·mol—1,若将含0.5 mol H2SO4的稀硫酸与1 mol NaOH固体混合,放出的热量大于57.3 kJ
D. 已知C(石墨,s) ![]() C(金刚石,s);ΔH=+1.9 kJ/mol,则金刚石比石墨稳定
C(金刚石,s);ΔH=+1.9 kJ/mol,则金刚石比石墨稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 W、X、Y、Z 的原子序数依次增大,X 的质子数是 W 与 Z 的质子数之和的一半。m、n、p 是由这些元素组成的二元化合物,r 是元素 Y 的气体单质,n 为淡黄色粉末, 相关物质转化关系如图所示。室温下,0.01mol/L s 溶液 pH 为 12。下列说法误错的是
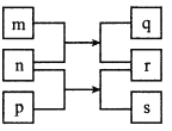
A.Z 是所在周期中原子半径最大的元素
B.简单离子半径大小:Y﹥Z﹥W
C.电负性:Y﹥X﹥W
D.n 中阴阳离子个数比为 1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室制取纯净、干燥的氯气,并验证氯气性质的装置。其中E瓶放有干燥红色布条;F中为红色的铜网,其右端出气管口放有脱脂棉。

(1)装置C中盛装的溶液是____________,D中试剂的作用是________。
(2)E中的红色布条是否退色?____,写出F中反应的化学反应方程式:____,其反应现象为_____________。
(3)新制氯水呈黄绿色说明其中含有_____,(填化学式,下同),将紫色石蕊溶液滴入可观察到的现象是_________________,说明其中含有__________。
(4)H中的试剂为___________,用来吸收多余氯气。工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白精,该反应的化学方程式为_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com