
【题目】下列依据热化学方程式得出的结论正确的是
A. 在25℃、101 kPa时,2 gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧热的热化学方程式为:2H2(g)+O2(g)![]() 2H2O(l);ΔH=-285.8kJ·mol-1
2H2O(l);ΔH=-285.8kJ·mol-1
B. CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)![]() 2CO(g)+O2(g);ΔH=+283.0 kJ/mol
2CO(g)+O2(g);ΔH=+283.0 kJ/mol
C. 在稀溶液中:H+(aq)+OH-(aq)= H2O(l);ΔH =-57.3 kJ·mol—1,若将含0.5 mol H2SO4的稀硫酸与1 mol NaOH固体混合,放出的热量大于57.3 kJ
D. 已知C(石墨,s) ![]() C(金刚石,s);ΔH=+1.9 kJ/mol,则金刚石比石墨稳定
C(金刚石,s);ΔH=+1.9 kJ/mol,则金刚石比石墨稳定
【答案】C
【解析】
A.燃烧热是指250C、101kPa下,1mol纯物质完全燃烧生成稳定的氧化物所放出的热量,2gH2的物质的量为1mol,氢气的燃烧热为285.8kJ/mol,表示H2燃烧热的热化学方程式为:H2(g)+![]() O2(g)=H2O(l);ΔH=-285.8kJ·mol-1,A项错误;
O2(g)=H2O(l);ΔH=-285.8kJ·mol-1,A项错误;
B.因为CO(g)的燃烧热是283.0kJ/mol,所以有热化学方程式2CO(g)+O2(g)=2CO2(g),ΔH=-566.0kJ·mol-1,作为该反应的逆反应的反应热数值相同,符号相反,故有2CO2(g)![]() 2CO(g)+O2(g);ΔH=+566.0 kJ/mol,B项错误;
2CO(g)+O2(g);ΔH=+566.0 kJ/mol,B项错误;
C. 由H+(aq)+OH-(aq)=H2O(l); ΔH=-57.3 kJ·mol—1可知,稀溶液中强酸与强碱发生中和反应生成1mol水时放出57.3kJ热量,0.5molH2SO4与1molNaOH恰好反应生成1mol水,但是1molNaOH固体在稀硫酸中溶解时要放出热量,所以该反应放出的热量大于57.3kJ,C项正确;
D.因为C(石墨,s)![]() C(金刚石,s);ΔH=+1.9 kJ/mol是吸热反应,所以金刚石的能量高于石墨的能量,物质具有的能量越低越稳定,所以石墨比金刚石稳定,D项错误;答案选C。
C(金刚石,s);ΔH=+1.9 kJ/mol是吸热反应,所以金刚石的能量高于石墨的能量,物质具有的能量越低越稳定,所以石墨比金刚石稳定,D项错误;答案选C。


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
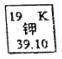
【题目】如图所示为元素周期表中钾元素框图,数据“39.10”表示的是________。
某化学兴趣小组欲除去16g固体氯化钠中混有的少量氯化钙和硫酸镁杂质,设计实验方案如下(已知常温下NaCl的溶解度为36g/100g![]() O)
O)

(1)加水溶解时,适合的取水量为________
A. 20mL B. 45mL C. 75mL D. 100mL
(2)为加快溶解速率,可采取的方法是________和________(任写2种)
(3)依次加入的过量试剂为________、________和________。
(4)溶液A中加入的适量酸为________,若该酸也加过量,对所得到氯化钠的纯度________(填“有”或“没有”)影响
(5)操作Ⅰ的名称是________;操作II的名称是________。两种操作中都用到的玻璃仪器是________。
(6)最后得到的固体氯化钠与原固体混合物中的氯化钠质量相比,结果________(填“增大”、“减小”或“不变”)。
(7)固体A中所含的盐的化学式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用阴离子交换膜控制电解液中OH-的浓度制备纳米Cu2O,反应为2Cu+H2O![]() Cu2O+H2↑,装置如图,下列说法中正确的是
Cu2O+H2↑,装置如图,下列说法中正确的是

A. 电解时Cl-通过交换膜向Ti极移动
B. 阳极发生的反应为:2Cu -2e- +2OH- = Cu2O+H2O
C. 阴极OH-放电,有O2生成
D. Ti电极和Cu电极生成物物质的量之比为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某恒定温度下,在一个2L的密闭容器中充入A气体、B气体,其浓度分别为2 mol/L,1 mol/L,且发生如下反应:3A(g)+2B(g) 4C(?)+2D(?)已知“?”代表C、D状态未确定;反应一段时间后达到平衡,测得生成1.6 mol C,且反应前后压强比为5:4,则下列说法中正确的是( )
①该反应的化学平衡常数表达式为:![]()
②此时B的转化率为35%
③增大该体系压强,平衡向右移动,但化学平衡常数不变
④增加C的量,A、B转化率不变
A. ①②B. ②③C. ③④D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)利用反应Cu+2FeCl3=CuCl2+2FeCl2设计成如图所示原电池,回答下列问题:

①写出电极反应式:正极__________________________ ;
②图中X溶液是_______________,
③原电池工作时,盐桥中的________(填“阳”或“阴”)离子向X溶液方向移动。
(2)如图是一个化学过程的示意图。

①甲池中OH-移向__________极(填“CH3OH”或“O2”)。
②写出通入CH3OH的电极的电极反应式_______________。
③乙池中总反应的离子方程式___________________。
④当乙池中B(A g)极的质量增加5.40g,若此时乙池中溶液的体积为500ml,则溶液的C(H+)是___________;此时丙池某电极析出1.60g某金属,则丙中的某盐溶液可能是______________(填序号)。A.MgSO4 B.CuSO4 C.NaCl D.AgNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案能达到相应实验目的的是
选项 | 实验目的 | 实验方案 |
A | 检验蔗糖水解生成葡萄糖 | 取适量蔗糖溶于盛有蒸馏水的试管中,滴入稀硫酸加热一段时间,冷却,滴入新制氢氧化铜悬浊液,加热至沸腾,观察有无砖红色沉淀 |
B | 实验室制备氢氧化铁胶体 | 向盛有25mL蒸馏水的烧杯中滴入5-6滴氯化铁饱和溶液,加热煮沸至溶液呈红褐色,停止加热 |
C | 比较AgCl、AgI的Ksp大小 | 向盛有10滴0.1mol/LAgNO3 溶液的试管中滴加0.1mol/LNaCl溶液至不再有沉淀生成,再滴加0.1mol/lKI溶液 |
D | 比较Mg、Al的金属性强弱 | 用导线连接镁和铝片,插入盛有氢氧化钠溶液的烧杯中,观察气泡 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中充入一定量的H2和N2,经测定反应开始后3s内v(N2)=0.2 mol·L-1·s-1,则3s末NH3的浓度为
A.0.4 mol·L-1B.0.6 mol·L-1C.0.9 mol·L-1D.1.2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理来解释的是
A. 用排饱和食盐水的方法收集氯气
B. 合成氨工业选择高温(合成氨反应为放热反应)
C. 增大压强,有利于SO2和O2反应生成SO3
D. 在Fe3++3SCN-![]() Fe(SCN)3反应达平衡时,增加KSCN的浓度,体系颜色变深
Fe(SCN)3反应达平衡时,增加KSCN的浓度,体系颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在150℃时(NH4)2CO3完全分解生成NH3、CO2和H2O,则其完全分解后所产生的气态混合物的密度是相同条件下氢气密度的( )
A. 96倍B. 48倍C. 12倍D. 32倍
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com