
【题目】下列实验方案能达到相应实验目的的是
选项 | 实验目的 | 实验方案 |
A | 检验蔗糖水解生成葡萄糖 | 取适量蔗糖溶于盛有蒸馏水的试管中,滴入稀硫酸加热一段时间,冷却,滴入新制氢氧化铜悬浊液,加热至沸腾,观察有无砖红色沉淀 |
B | 实验室制备氢氧化铁胶体 | 向盛有25mL蒸馏水的烧杯中滴入5-6滴氯化铁饱和溶液,加热煮沸至溶液呈红褐色,停止加热 |
C | 比较AgCl、AgI的Ksp大小 | 向盛有10滴0.1mol/LAgNO3 溶液的试管中滴加0.1mol/LNaCl溶液至不再有沉淀生成,再滴加0.1mol/lKI溶液 |
D | 比较Mg、Al的金属性强弱 | 用导线连接镁和铝片,插入盛有氢氧化钠溶液的烧杯中,观察气泡 |
A. A B. B C. C D. D
科目:高中化学 来源: 题型:
【题目】影响化学反应速率的因素很多,某化学小组用实验的方法进行探究。
I.探究活动一:
备选药品:铁片、锌片、0.5mol/LH2SO4、1.5mol/LH2SO4、18.4mol/LH2SO4
甲同学研究的实验报告
实验步骤 | 现象 | 结论 |
①分别取等体积的1.5mol/L的硫酸于两支试管中; ②_____________________。 | 反应速率: 锌>铁 | 金属的性质越活泼,反应速率越快 |
(1)甲同学实验报告中的实验步骤②为__________________________________。
(2)甲同学的实验目的是_______________________________;要得出正确的实验结论,还需控制的实验条件是__________________。
乙同学为了定量研究浓度对化学反应速率的影响,利用如图所示装置进行实验:

(3)乙同学在实验中需要测定的数据是_________________________。
(4)乙同学不会选用___________mol/L硫酸完成该实验,理由是_________________。
II.探究活动二:
备选药品:0.1mol/LNa2S2O3溶液、0.2mol/LNa2S2O3溶液、0.1mol/LH2SO4溶液、0.2mol/LH2SO4溶液。
已知:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O
实验 编号 | Na2S2O3用量 | H2SO4用量 | 温度(℃) |
① | 0.1mol/L5mL | 0.1mol/L5mL | 10 |
② | 0.2mol/L5mL | 0.2mol/L5mL | 25 |
③ | 0.1mol/L5mL | 0.1mol/L5mL | 25 |
④ | 0.1mol/L5mL | 0.1mol/L5mL | 40 |
(1)若想探究温度对化学反应速率的影响,可选的实验编号有___________。
(2)若想探究浓度对化学反应速率的影响,可选的实验编号有___________。
(3)在该实验过程中,需要观察和记录________________,来比较化学反应速率的快慢。
(4)Na2S2O3在碱性溶液中可被I2氧化为Na2SO4,写出该反应的离子方程式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如下图所示,左室容积为右室的两倍,温度相同,现分别按照如图所示的量充入气体,同时加入少量固体催化剂使两室内气体充分反应达到平衡,打开活塞,继续反应再次达到平衡,下列说法正确的是_____

A.第一次平衡时,SO2的物质的量右室更多
B.通入气体未反应前,左室压强和右室一样大
C.第一次平衡时,左室内压强一定小于右室
D.第二次平衡时,SO2的总物质的量比第一次平衡时左室SO2的物质的量的2倍还要多
(2)NH3合成常见的化肥尿素【化学式为CO(NH2)2】分为三步,其中第一步为:2NH3(g)+CO2(g)![]() NH2COONH4(s) ΔH= -159.5kJ/mol,对于这个反应,在2L等容密闭容器中充入2molNH3和1molCO2,平衡时放出127.6kJ的热量,若反应温度不变,在该容器中充入2.8molNH3和1.4molCO2,到达平衡时,c(NH3)为___________。
NH2COONH4(s) ΔH= -159.5kJ/mol,对于这个反应,在2L等容密闭容器中充入2molNH3和1molCO2,平衡时放出127.6kJ的热量,若反应温度不变,在该容器中充入2.8molNH3和1.4molCO2,到达平衡时,c(NH3)为___________。
(3)①室温下,在0.5mol/L纯碱溶液中加入少量水,由水电离出的c(H+)×c(OH-)_________。(填“变大”、“变小”、“不变”)
②已知Ksp(Ag2CrO4)=1.0×10-12,向0.2mol/L的AgNO3溶液中加入等体积的0.00008mol/LK2CrO4溶液,则溶液中的c(CrO42-)=___________。
③室温下,0.1mol/LNaHCO3溶液的pH值______0.1mol/LNa2SO3溶液的pH值(填“>”、“<”、“=”)已知:
H2CO3 | K1=4.3×10-7 | K2=5.6×10-11 |
H2SO3 | K1=1.54×10-2 | K2=1.02×10-7 |
(4)有一种可充电电池Na—Al/FeS,电池工作时Na+的物质的量保持不变,并且是用含Na+的导电固体作为电解质,已知该电池正极反应式为2Na++FeS+2e—=Na2S+Fe,则该电池在充电时,阳极发生反应的物质是____________,放电时负极反应式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂除去溶液中的NaCl和Na2SO4,从而得到纯净的NaNO3溶液。相应的实验过程可用下图表示:

请回答下列问题:
(1)上述实验流程中加入过量的Na2CO3的目的是____。
(2)按此实验方案得到的溶液3中肯定含有___(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的___,之后若要获得固体NaNO3需进行的实验操作是___(填操作名称)。
(3)下列是某学生设计NaCl、Na2SO4、NaNO3混合物中Cl-、SO42-的检验步骤请根据内容填空:
①首先检验__离子,应加入过量的___,检验是否加入过量的方法___。
②将所得混合物过滤,然后在溶液中加入___试剂检验另一离子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是
A. 在25℃、101 kPa时,2 gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧热的热化学方程式为:2H2(g)+O2(g)![]() 2H2O(l);ΔH=-285.8kJ·mol-1
2H2O(l);ΔH=-285.8kJ·mol-1
B. CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)![]() 2CO(g)+O2(g);ΔH=+283.0 kJ/mol
2CO(g)+O2(g);ΔH=+283.0 kJ/mol
C. 在稀溶液中:H+(aq)+OH-(aq)= H2O(l);ΔH =-57.3 kJ·mol—1,若将含0.5 mol H2SO4的稀硫酸与1 mol NaOH固体混合,放出的热量大于57.3 kJ
D. 已知C(石墨,s) ![]() C(金刚石,s);ΔH=+1.9 kJ/mol,则金刚石比石墨稳定
C(金刚石,s);ΔH=+1.9 kJ/mol,则金刚石比石墨稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不能够用勒夏特勒原理来解释的是
A. 实验室用排饱和食盐水的方法收集氯气
B. 溴水中有下列平衡Br2+H2O![]() HBr+HBrO,当加入硝酸银溶液后(AgBr是淡黄色沉淀),溶液颜色变浅
HBr+HBrO,当加入硝酸银溶液后(AgBr是淡黄色沉淀),溶液颜色变浅
C. SO2催化氧化制SO3的过程中使用过量的氧气,以提高二氧化硫的转化率
D. 恒温、恒压条件下,在2NO2![]() N2O4平衡体系中充入He后,体系颜色变浅
N2O4平衡体系中充入He后,体系颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配离子的稳定性可用K不稳衡量,例如[Ag(NH3)2]+的K不稳=![]() 。在一定温度下,向0.1mol/L硝酸银溶液中滴入稀氨水,发生反应Ag++2NH3
。在一定温度下,向0.1mol/L硝酸银溶液中滴入稀氨水,发生反应Ag++2NH3![]() [Ag(NH3)2]+。溶液中pNH3与δ(X)的关系如图其中pNH3=-1g[c(NH3)]、δ(X)=
[Ag(NH3)2]+。溶液中pNH3与δ(X)的关系如图其中pNH3=-1g[c(NH3)]、δ(X)= ![]() (X代表Ag+或[Ag(NH3)2]+)。下列说法正确的是
(X代表Ag+或[Ag(NH3)2]+)。下列说法正确的是
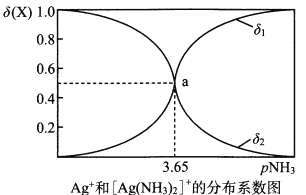
A. 图中δ1代表的是δ([Ag(NH3)2]+) B. 向溶液中滴入稀硝酸,δ(Ag+)减小
C. 该溶液中c(NH4+)+c(H+)=c(OH-) D. 该温度时,K不稳([Ag(NH3)2]+)=107.3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成气(CO、H2)是一种重要的化工原料气。合成气制取有多种方法,如煤的气化、天然气部分氧化等。回答下列问题:
I.合成气的制取
(1)煤的气化制取合成气。
已知:①H2O(g)=H2O(l) △H=-44kJ/mol;
②部分物质的燃烧热:

则反应C(s)+H2O(g)=CO(g)+H2(g)的△H=___________kJ/mol。
(2)天然气部分氧化制取合成气。
如果用O2(g)、H2O(g)、CO2(g)混合物氧化CH4(g),欲使制得的合成气中CO和H2的物质的量之比为1︰2,则原混合物中H2O(g)与CO2(g)的物质的量之比为___________。
Ⅱ.利用合成气合成乙醇
在一定条件下,向容积为2L的恒容密闭容器中投入2 mol CO和4molH2,发生反应:2CO(g)+4H2(g)![]() CH3CH2OH(g)+H2O(g)。
CH3CH2OH(g)+H2O(g)。
(1)写出该反应的平衡常数表达式___________。
(2)下列情况能作为判断反应体系达到平衡的标志是___________(填序号)。
a.压强不再变化 b.平均摩尔质量不再变化 c.密度不再变化
(3)反应起始压强记为p1、平衡后记为p2,平衡时H2的转化率为___________。(用含p1、p2的代数式表示)
Ⅲ.合成乙醇的条件选择
为探究合成气制取乙醇的适宜条件,某科研团队对不同温度、不同Rh质量分数的催化剂对CO的吸附强度进行了研究,实验数据如图。CO的非离解吸附是指CO尚未乙醇化,离解吸附是指CO已经乙醇化。

由此可见催化剂温度对CO吸附强度的影响是___________;用Rh作催化剂,合成气制取乙醇的适宜温度是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了验证某混合气体由H2、CO和HCl组成,请从图中选择适当的实验装置设计实验,并回答下列问题。(假设每步反应均完全)

(1)装置连接的顺序是___(用字母表示)。
(2)你所选择的第一个装置的作用是_____。
(3)写出你所选最后一个装置中发生反应的化学方程式_____。
(4)A装置在实验过程中玻璃管内的现象是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com