
【题目】合成气(CO、H2)是一种重要的化工原料气。合成气制取有多种方法,如煤的气化、天然气部分氧化等。回答下列问题:
I.合成气的制取
(1)煤的气化制取合成气。
已知:①H2O(g)=H2O(l) △H=-44kJ/mol;
②部分物质的燃烧热:

则反应C(s)+H2O(g)=CO(g)+H2(g)的△H=___________kJ/mol。
(2)天然气部分氧化制取合成气。
如果用O2(g)、H2O(g)、CO2(g)混合物氧化CH4(g),欲使制得的合成气中CO和H2的物质的量之比为1︰2,则原混合物中H2O(g)与CO2(g)的物质的量之比为___________。
Ⅱ.利用合成气合成乙醇
在一定条件下,向容积为2L的恒容密闭容器中投入2 mol CO和4molH2,发生反应:2CO(g)+4H2(g)![]() CH3CH2OH(g)+H2O(g)。
CH3CH2OH(g)+H2O(g)。
(1)写出该反应的平衡常数表达式___________。
(2)下列情况能作为判断反应体系达到平衡的标志是___________(填序号)。
a.压强不再变化 b.平均摩尔质量不再变化 c.密度不再变化
(3)反应起始压强记为p1、平衡后记为p2,平衡时H2的转化率为___________。(用含p1、p2的代数式表示)
Ⅲ.合成乙醇的条件选择
为探究合成气制取乙醇的适宜条件,某科研团队对不同温度、不同Rh质量分数的催化剂对CO的吸附强度进行了研究,实验数据如图。CO的非离解吸附是指CO尚未乙醇化,离解吸附是指CO已经乙醇化。

由此可见催化剂温度对CO吸附强度的影响是___________;用Rh作催化剂,合成气制取乙醇的适宜温度是___________。
【答案】+ 131. 3 2 : 1 K=c(H2O)![]() c( CH3CH2OH) /[c2(CO)
c( CH3CH2OH) /[c2(CO)![]() c4(H2 )] ab 3(p1-p2)/ 2p1
c4(H2 )] ab 3(p1-p2)/ 2p1 ![]() 100% 在低温区,温度升高、不同催化剂对CO的吸附强度均增大;在高温区,温度升高、不同催化剂对CO的吸附强度均减小;相同温度下,催化剂中Rh质量分数越高,CO的吸附强度越大 550
100% 在低温区,温度升高、不同催化剂对CO的吸附强度均增大;在高温区,温度升高、不同催化剂对CO的吸附强度均减小;相同温度下,催化剂中Rh质量分数越高,CO的吸附强度越大 550![]()
【解析】
I. (1)根据已知条件可写出热化学方程式: ①H2O(g)= H2O(l)△H=-44 kJ/ mol;②C(s)+O2(g)=CO2(g)△H=-393.5 kJ/ mol;③CO(g)+1/2O2(g)=CO2(g)△H=-283.0 kJ/ mol ;④H2(g)+1/2 O2(g)= H2O(l) △H=-285.8 kJ/ mol; 则①+②-③-④为C(s)+ H2O(g)= CO(g)+H2(g) △H =+ 131.3 kJ/mol。答案:+ 131.3。
(2)制得的合成气中n(CO) : n(H2)=1 : 2,要求O2(g)、H2O(g)、CO2(g)、CH4(g)混合物里n(C) : n(H)=1 : 4;由于CH4(g)中n(C) :n(H)=1 : 4,则n(H2O) : n(CO2)=2 : 1。答案:2:1。
Ⅱ. (1)由反应的化学方程可知,平衡常数的表达式为K=c(H2O)·c(CH3CH2OH)/[c2(CO)·c4(H2 )]
(2)温度、容积一定时,压强与物质的量成正比,而该反应为化学计量数改变的反应,随着反应的进行压强减小,直到平衡时压强为定值,故a正确;平均摩尔质量M=m/n,m不变、M不变,则n不变,已达平衡,故b正确;![]() =m/V,m、V不变,ρ恒为定值,故c错误。答案:ab。
=m/V,m、V不变,ρ恒为定值,故c错误。答案:ab。
(3)在反应2CO(g)+4H2(g)![]() CH3CH2OH(g)+H2O(g)中,减少的气体物质的量等于参加反应H2的物质的量,设转化率为a(H2),故4a(H2):(2+4)=(p1-p2):p1,解得a(H2)=3(p1-p2)/2p1
CH3CH2OH(g)+H2O(g)中,减少的气体物质的量等于参加反应H2的物质的量,设转化率为a(H2),故4a(H2):(2+4)=(p1-p2):p1,解得a(H2)=3(p1-p2)/2p1 ![]() 100%。答案:3(p1-p2)/2p1
100%。答案:3(p1-p2)/2p1 ![]() 100%。
100%。
Ill.分析图像可知,催化剂对CO的吸附分非离解吸附和离解吸附两种。图像表明,无论何种吸附,①温度对CO的吸附强度的影响是:在低温区,温度升高、CO的吸附强度增大;在高温区,温度升高、CO的吸附强度减小。②催化剂中Rh质量分数对CO的吸附强度的影响是:相同温度下,催化剂中Rh质量分数越高、CO的吸附强度越大。从图中可知,合成乙醇的适宜温度需控制在CO离解吸附强度最大处即550℃。答案:在低温区,温度升高、不同催化剂对CO的吸附强度增大;在高温区,温度升高、不同催化剂对CO的吸附强度减小;相同温度下,催化剂中Rh质量分数越高、CO的吸附强度越大;550℃。


 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
【题目】图是工业生产上的氯化氢合成塔,请写出各处物质的化学式:
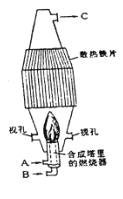
(1)B________,C________。
(2)工业上制备HC1的化学方程式是____________。
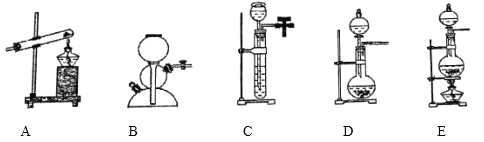
(3)实验室常用NaCl和浓硫酸起反应制取氯化氢,当微热时,发生装置应选用下列装置的________(填编号)
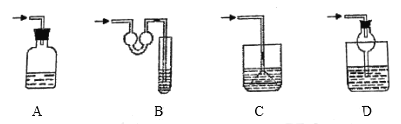
(4)以下各种尾气吸收装置中,适合于吸收HCl气体,而且能防止倒吸的是________。
(5)图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:

(6)该浓盐酸中HC1的物质的量浓度为________mol/L.
(7)取用任意体积的该盐酸时,下列物理量中不随所取体积的多少而变化的是________
A.溶液中HC1的物质的量
B.溶液的浓度
C.溶液中Cl-的数目
D.溶液的密度
(8)某学生欲用上述浓盐酸和蒸馏水配制500mL物质的量浓度为0.40mol/L的稀盐酸。该学生需要量取________mL上述浓盐酸进行配制。
(9)下列操作中,使溶液的浓度偏低的操作是________
A.摇匀后,液面稍低于刻度线,再加水使之相平
B.转移时,有少量溶液洒到实验桌上
C.溶液转移前,容量瓶中已经有少量蒸馏水
D.定容时,不小心加水超过了刻度线,趁还未摇匀,立刻吸出多余的水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案能达到相应实验目的的是
选项 | 实验目的 | 实验方案 |
A | 检验蔗糖水解生成葡萄糖 | 取适量蔗糖溶于盛有蒸馏水的试管中,滴入稀硫酸加热一段时间,冷却,滴入新制氢氧化铜悬浊液,加热至沸腾,观察有无砖红色沉淀 |
B | 实验室制备氢氧化铁胶体 | 向盛有25mL蒸馏水的烧杯中滴入5-6滴氯化铁饱和溶液,加热煮沸至溶液呈红褐色,停止加热 |
C | 比较AgCl、AgI的Ksp大小 | 向盛有10滴0.1mol/LAgNO3 溶液的试管中滴加0.1mol/LNaCl溶液至不再有沉淀生成,再滴加0.1mol/lKI溶液 |
D | 比较Mg、Al的金属性强弱 | 用导线连接镁和铝片,插入盛有氢氧化钠溶液的烧杯中,观察气泡 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由乙烯和丙二酸等物质合成I,合成路线如下:
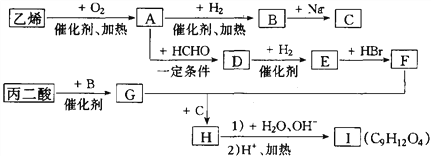
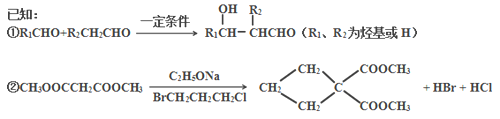
请回答下列问题:
(1)丙二酸的结构简式是_________。
(2)有机物D的分子式为C5H10O4,其官能团的名称是__________。
(3)写出A→B的化学反应方程式______________________________________。
(4)E→F的反应类型是______________。
(5)在一定条件下,丙二酸与乙二醇通过发生缩聚反应生成高分子化合物。写出该高分子化合物的化学式______________。
(6)I的同分异构体中属于芳香族化合物且满足下列条件的有_____种。
①苯环上有4个取代基;②与FeCl3溶液发生显色反应;③每种同分异构体1 mol能与1 mol碳酸钠发生反应,也能与足量金属钠反应生成2molH2;④一个碳原子连接2个或2个以上羟基不稳定。
其中苯环上的一氯代物只有一种的是___________________。(写出其中一种的结构简式)
(7)丙二酸可由乙烯、甲醛为原料制得(其它无机试剂任选)。请模仿并画出合成路线图。___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理来解释的是
A. 用排饱和食盐水的方法收集氯气
B. 合成氨工业选择高温(合成氨反应为放热反应)
C. 增大压强,有利于SO2和O2反应生成SO3
D. 在Fe3++3SCN-![]() Fe(SCN)3反应达平衡时,增加KSCN的浓度,体系颜色变深
Fe(SCN)3反应达平衡时,增加KSCN的浓度,体系颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磺酰氯(SO2Cl2)是一种重要的有机合成试剂,主要用作氯化剂或氯磺化剂,也用于制造医药品、染料、表面活性剂等。实验室可利用SO2与Cl2反应制取少量SO2Cl2,所需装置如图所示(部分装置略):

已知:①Na2SO3+H2SO4![]() Na2SO4+H2O+SO2↑。
Na2SO4+H2O+SO2↑。
②SO2Cl2的熔点为-54.1℃,沸点为69.1℃,密度为1.67g/mL。它在常温下较稳定、遇水剧烈水解,100℃以上易分解。
回答下列问题:
(1)检查装置A气密性的操作是___________。
(2)选择实验装置(A~E)并连接接口(a~h)顺序:(A-a)___________(b-B-c)___________(h-E)(装置可重复使用)。
(3)B装置中的冷凝管需连接冷凝水,它应从___________(填“m”或“n”)接入。
(4)实验完成后装置D中可能观察到的现象是___________,产生该现象的原因是___________。
(5)设计如下实验,以检验SO2Cl2产品中是否溶有杂质。
①组装仪器,检查气密性;
②添加试剂抽取8.0mL液体产品,组装仪器;
③___________,缓慢推动注射器活塞将液体产品全部推入锥形瓶中,观察到的实验现象有___________;
④充分反应后,过滤、洗涤、干燥、称量固体质量为23.3g,表明液体产品中溶有___________,其理由是___________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物中可能含有K+、Na+、Cl﹣、CO32﹣、SO42﹣等离子,将该固体溶解于蒸馏水,对所得溶液进行如下实验:下列推断正确的是( )

A. 该混合物一定是K2CO3和NaCl
B. 该混合物可能是Na2CO3和KCl
C. 该混合物可能是Na2SO4和Na2CO3
D. 该混合物一定是K2SO4和NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对![]() 溶液进行下列操作,观察到的现象与
溶液进行下列操作,观察到的现象与![]() 水解有关的是
水解有关的是![]()
![]()
A. 滴加NaOH溶液有沉淀产生 B. 加热蒸干灼烧得到红棕色固体
C. 通入![]() 气体有沉淀产生 D. 滴加KSCN试液溶液变红
气体有沉淀产生 D. 滴加KSCN试液溶液变红
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图所示装置的叙述,正确的是

A. 铜是负极,铜片上有气泡产生 B. 铜离子在铜片表面被还原
C. 电流从锌片经导线流向铜片 D. 盐桥中阳离子进入左烧杯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com