
����Ŀ��Ӱ�컯ѧ��Ӧ���ʵ����غܶ࣬ij��ѧС����ʵ��ķ�������̽����
I��̽���һ��
��ѡҩƷ����Ƭ��пƬ��0.5mol/LH2SO4��1.5mol/LH2SO4��18.4mol/LH2SO4
��ͬѧ�о���ʵ�鱨��
ʵ�鲽�� | ���� | ���� |
�ٷֱ�ȡ�������1.5mol/L����������֧�Թ��У� ��_____________________�� | ��Ӧ���ʣ� п>�� | ����������Խ���ã���Ӧ����Խ�� |
(1)��ͬѧʵ�鱨���е�ʵ�鲽���Ϊ__________________________________��
(2)��ͬѧ��ʵ��Ŀ����_______________________________��Ҫ�ó���ȷ��ʵ����ۣ�������Ƶ�ʵ��������__________________��
��ͬѧΪ�˶����о�Ũ�ȶԻ�ѧ��Ӧ���ʵ�Ӱ�죬������ͼ��ʾװ�ý���ʵ�飺

(3)��ͬѧ��ʵ������Ҫ�ⶨ��������_________________________��
(4)��ͬѧ����ѡ��___________mol/L������ɸ�ʵ�飬������_________________��
II��̽�������
��ѡҩƷ��0.1mol/LNa2S2O3��Һ��0.2mol/LNa2S2O3��Һ��0.1mol/LH2SO4��Һ��0.2mol/LH2SO4��Һ��
��֪��Na2S2O3��H2SO4��Na2SO4��S����SO2����H2O
ʵ�� ��� | Na2S2O3���� | H2SO4���� | �¶ȣ����� |
�� | 0.1mol/L5mL | 0.1mol/L5mL | 10 |
�� | 0.2mol/L5mL | 0.2mol/L5mL | 25 |
�� | 0.1mol/L5mL | 0.1mol/L5mL | 25 |
�� | 0.1mol/L5mL | 0.1mol/L5mL | 40 |
(1)����̽���¶ȶԻ�ѧ��Ӧ���ʵ�Ӱ�죬��ѡ��ʵ������___________��
(2)����̽��Ũ�ȶԻ�ѧ��Ӧ���ʵ�Ӱ�죬��ѡ��ʵ������___________��
(3)�ڸ�ʵ������У���Ҫ�۲�ͼ�¼________________�����Ƚϻ�ѧ��Ӧ���ʵĿ�����
(4)Na2S2O3�ڼ�����Һ�пɱ�I2����ΪNa2SO4��д���÷�Ӧ�����ӷ���ʽ___________________��
���𰸡��ֱ�Ͷ���С����״��ͬ������п �о����������������뷴Ӧ���ʵĹ�ϵ �¶���ͬ һ��ʱ���ڲ������������������һ����������������ʱ�䣩 18.4 �����£�п��18.4mol/LH2SO4��Ӧ����SO2,ʹ�Ա�ʵ��ķ�Ӧԭ����ͬ�� 18.4mol/LH2SO4ʹ���ۻ� �����ܻ�����ۻ���������� ������ ���ɵ������ij��������ʱ�� S2O32-+10OH-+4I2=2SO42-+8I-+5H2O
��������
I����1����ͬѧ����ʵ�鲽���Ϊ������Ũ�ȷֱ���0.5 mol/L��2 mol/L�������м���Ͷ���С����״��ͬ������п�����֣���Ӧ���ʣ�п>����˵������������Խ���ã���Ӧ����Խ����
��2����ͬѧ��ʵ��Ŀ�����о����������������뷴Ӧ���ʵĹ�ϵ��Ҫ�ó���ȷ��ʵ����ۣ�������Ƶ�ʵ�������Ƿ�Ӧ�¶�Ӧ����ͬ�����������γɶ���ʵ����
��3����ͬѧ��ʵ����Ӧ�òⶨ��������һ��ʱ���ڲ������������������һ����������������ʱ�䣩������ͬ��ʱ���ڲ������������Խ����Ӧ����Խ�죻�����ռ���ͬ��������壬��Ҫ��ʱ��Խ�̣���Ӧ����Խ����
��4����ͬѧ����ѡ��18.4 mol/L������ɸ�ʵ�飬����ΪFe��Ũ�����лᷢ���ۻ�����
II��(1)��Ҫ̽���¶ȶԻ�ѧ��Ӧ���ʵ�Ӱ�죬Ӧ����ֻ�ı��¶ȣ��������������䡣��ѡ��ʵ�����Ϊ�����ܻ�����ۻ���������ܣ�
(2) ����̽��Ũ�ȶԻ�ѧ��Ӧ���ʵ�Ӱ�죬Ӧ����ֻ�ı�Ũ�ȣ��������������䡣��ѡ��ʵ�����Ϊ�����ۣ�
(3)�ڸ�ʵ������У���Ҫ�۲�ͼ�¼���ɵ������ij��������ʱ�䣬���Ƚϻ�ѧ��Ӧ���ʵĿ�����
(4)Na2S2O3�ڼ�����Һ�пɱ�I2����ΪNa2SO4����������ԭΪI-����Ӧ�����ӷ���ʽΪS2O32-+10OH-+4I2=2SO42-+8I-+5H2O��


 ��һ������Ԫͬ�����ؾ�ϵ�д�
��һ������Ԫͬ�����ؾ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ϻ�ʵ�ʲ����ڹ�ҵ�������ǣ� ��
A.Na��![]() ��ȼ����NaClB.Ũ
��ȼ����NaClB.Ũ![]() ��NaCl��Ӧ��HCl
��NaCl��Ӧ��HCl
C.![]() ��ʯ����������Ư�۾�D.H2��
��ʯ����������Ư�۾�D.H2��![]() ��ֻ�Ϲ�����HCl
��ֻ�Ϲ�����HCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ӦCH4(g)+CO2(g) ![]() 2CO(g)+2H2(g) ��H>0,���������CH4ƽ��ת���ʵ�������
2CO(g)+2H2(g) ��H>0,���������CH4ƽ��ת���ʵ�������
A. ���µ�ѹ B. ���¸�ѹ C. ���¸�ѹ D. ���µ�ѹ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������������� �ڱ��� �������� �������� �ݹ����У��е��ɸߵ���˳����ȷ���ǣ� ��
A. �٢ڢۢܢ�B. �ݢ٢ۢܢ�C. �ݢۢܢ٢�D. �ۢܢݢڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
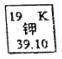
����Ŀ����ͼ��ʾΪԪ�����ڱ��м�Ԫ�ؿ�ͼ��������39.10����ʾ����________��
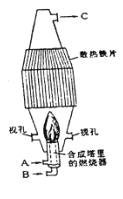
ij��ѧ��ȤС������ȥ16g�����Ȼ����л��е������Ȼ��ƺ�����þ���ʣ����ʵ�鷽�����£���֪������NaCl���ܽ��Ϊ36g/100g![]() O��
O��

��1����ˮ�ܽ�ʱ���ʺϵ�ȡˮ��Ϊ________
A. 20mL B. 45mL C. 75mL D. 100mL
��2��Ϊ�ӿ��ܽ����ʣ��ɲ�ȡ�ķ�����________��________����д2�֣�
��3�����μ���Ĺ����Լ�Ϊ________��________��________��
��4����ҺA�м����������Ϊ________��������Ҳ�ӹ����������õ��Ȼ��ƵĴ���________��������������û������Ӱ��
��5���������������________������II��������________�����ֲ����ж��õ��IJ���������________��
��6�����õ��Ĺ����Ȼ�����ԭ���������е��Ȼ���������ȣ����________������������������С����������������
��7������A���������εĻ�ѧʽΪ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȡ�ϴ�����һ��������ò��õķ����ǣ� ��
A. �����������ӦB. ��ϩ���Ȼ��ⷴӦ
C. ��ϩ��������ӦD. ��ϩ�������������Ļ�������ڳ����·�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����У���������ķ�����һ����ȵ��� �� ��
A. �¶���ͬ�������ͬ��O2��N2 B. �����ȡ��ܶȲ��ȵ�CO��C2H4
C. ������ȡ��ܶȲ��ȵ�CO��C2H4 D. ѹǿ��ͬ�������ͬ��O2��N2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
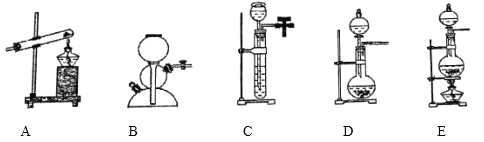
����Ŀ��ͼ�ǹ�ҵ�����ϵ��Ȼ���ϳ�������д���������ʵĻ�ѧʽ��
��1��B________��C________��
��2����ҵ���Ʊ�HC1�Ļ�ѧ����ʽ��____________��
��3��ʵ���ҳ���NaCl��Ũ������Ӧ��ȡ�Ȼ��⣬����ʱ������װ��Ӧѡ������װ�õ�________�����ţ�
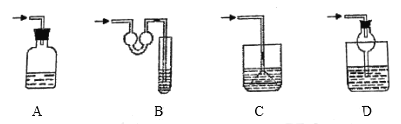
��4�����¸���β������װ���У��ʺ�������HCl���壬�����ܷ�ֹ��������________��
��5��ͼΪʵ����ijŨ�����Լ�ƿ��ǩ�ϵ��й����ݣ��Ը��ݱ�ǩ�ϵ��й����ݻش��������⣺

��6����Ũ������HC1�����ʵ���Ũ��Ϊ________mol/L.
��7��ȡ����������ĸ�����ʱ�������������в�����ȡ����Ķ��ٶ��仯����________
A.��Һ��HC1�����ʵ���
B.��Һ��Ũ��
C.��Һ��Cl-����Ŀ
D.��Һ���ܶ�
��8��ijѧ����������Ũ���������ˮ����500mL���ʵ���Ũ��Ϊ0.40mol/L��ϡ���ᡣ��ѧ����Ҫ��ȡ________mL����Ũ����������ơ�
��9�����в����У�ʹ��Һ��Ũ��ƫ�͵IJ�����________
A.ҡ�Ⱥ�Һ���Ե��ڿ̶��ߣ��ټ�ˮʹ֮��ƽ
B.ת��ʱ����������Һ����ʵ������
C.��Һת��ǰ������ƿ���Ѿ�����������ˮ
D.����ʱ����С�ļ�ˮ�����˿̶��ߣ��û�δҡ�ȣ��������������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�鷽���ܴﵽ��Ӧʵ��Ŀ�ĵ���
ѡ�� | ʵ��Ŀ�� | ʵ�鷽�� |
A | ��������ˮ������������ | ȡ������������ʢ������ˮ���Թ��У�����ϡ�������һ��ʱ�䣬��ȴ����������������ͭ����Һ�����������ڣ��۲�����ש��ɫ���� |
B | ʵ�����Ʊ������������� | ��ʢ��25mL����ˮ���ձ��е���5-6���Ȼ���������Һ�������������Һ�ʺ��ɫ��ֹͣ���� |
C | �Ƚ�AgCl��AgI��Ksp��С | ��ʢ��10��0.1mol/LAgNO3 ��Һ���Թ��еμ�0.1mol/LNaCl��Һ�������г������ɣ��ٵμ�0.1mol/lKI��Һ |
D | �Ƚ�Mg��Al�Ľ�����ǿ�� | �õ�������þ����Ƭ������ʢ������������Һ���ձ��У��۲����� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com