
ΓΨΧβΡΩΓΩΘ®1Θ©»γœ¬ΆΦΥυ ΨΘ§Ήσ “»ίΜΐΈΣ”“ “ΒΡΝΫ±ΕΘ§Έ¬Ε»œύΆ§Θ§œ÷Ζ÷±πΑ¥’’»γΆΦΥυ ΨΒΡΝΩ≥δ»κΤχΧεΘ§Ά§ ±Φ”»κ…ΌΝΩΙΧΧε¥ΏΜ·ΦΝ ΙΝΫ “ΡΎΤχΧε≥δΖ÷Ζ¥”Π¥οΒΫΤΫΚβΘ§¥ρΩΣΜν»ϊΘ§ΦΧ–χΖ¥”Π‘Ό¥Έ¥οΒΫΤΫΚβΘ§œ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «_____

AΘ°ΒΎ“Μ¥ΈΤΫΚβ ±Θ§SO2ΒΡΈο÷ ΒΡΝΩ”“ “ΗϋΕύ
BΘ°Ά®»κΤχΧεΈ¥Ζ¥”Π«ΑΘ§Ήσ “―Ι«ΩΚΆ”“ ““Μ―υ¥σ
CΘ°ΒΎ“Μ¥ΈΤΫΚβ ±Θ§Ήσ “ΡΎ―Ι«Ω“ΜΕ®–Γ”Ύ”“ “
DΘ°ΒΎΕΰ¥ΈΤΫΚβ ±Θ§SO2ΒΡΉήΈο÷ ΒΡΝΩ±»ΒΎ“Μ¥ΈΤΫΚβ ±Ήσ “SO2ΒΡΈο÷ ΒΡΝΩΒΡ2±ΕΜΙ“ΣΕύ
Θ®2Θ©NH3Κœ≥…≥ΘΦϊΒΡΜ·Ζ ΡρΥΊΓΨΜ·―ß ΫΈΣCO(NH2)2ΓΩΖ÷ΈΣ»ΐ≤ΫΘ§Τδ÷–ΒΎ“Μ≤ΫΈΣΘΚ2NH3(g)+CO2(g)![]() NH2COONH4(s) ΠΛH= -159.5kJ/molΘ§Ε‘”Ύ’βΗωΖ¥”ΠΘ§‘Ύ2LΒ»»ίΟή±’»ίΤς÷–≥δ»κ2molNH3ΚΆ1molCO2Θ§ΤΫΚβ ±Ζ≈≥ω127.6kJΒΡ»»ΝΩΘ§»τΖ¥”ΠΈ¬Ε»≤Μ±δΘ§‘ΎΗΟ»ίΤς÷–≥δ»κ2.8molNH3ΚΆ1.4molCO2Θ§ΒΫ¥οΤΫΚβ ±Θ§cΘ®NH3Θ©ΈΣ___________ΓΘ
NH2COONH4(s) ΠΛH= -159.5kJ/molΘ§Ε‘”Ύ’βΗωΖ¥”ΠΘ§‘Ύ2LΒ»»ίΟή±’»ίΤς÷–≥δ»κ2molNH3ΚΆ1molCO2Θ§ΤΫΚβ ±Ζ≈≥ω127.6kJΒΡ»»ΝΩΘ§»τΖ¥”ΠΈ¬Ε»≤Μ±δΘ§‘ΎΗΟ»ίΤς÷–≥δ»κ2.8molNH3ΚΆ1.4molCO2Θ§ΒΫ¥οΤΫΚβ ±Θ§cΘ®NH3Θ©ΈΣ___________ΓΘ
Θ®3Θ©ΔΌ “Έ¬œ¬Θ§‘Ύ0.5mol/L¥ΩΦν»ή“Κ÷–Φ”»κ…ΌΝΩΥ°Θ§”…Υ°Βγάκ≥ωΒΡc(H+)ΓΝc(OHΘ≠)_________ΓΘΘ®ΧνΓΑ±δ¥σΓ±ΓΔΓΑ±δ–ΓΓ±ΓΔΓΑ≤Μ±δΓ±Θ©
ΔΎ“―÷ΣKspΘ®Ag2CrO4Θ©=1.0ΓΝ10Θ≠12Θ§œρ0.2mol/LΒΡAgNO3»ή“Κ÷–Φ”»κΒ»ΧεΜΐΒΡ0.00008mol/LK2CrO4»ή“ΚΘ§‘ρ»ή“Κ÷–ΒΡc(CrO42Θ≠)=___________ΓΘ
Δέ “Έ¬œ¬Θ§0.1mol/LNaHCO3»ή“ΚΒΡpH÷Β______0.1mol/LNa2SO3»ή“ΚΒΡpH÷ΒΘ®ΧνΓΑ>Γ±ΓΔΓΑ<Γ±ΓΔΓΑ=Γ±Θ©“―÷ΣΘΚ
H2CO3 | K1=4.3ΓΝ10Θ≠7 | K2=5.6ΓΝ10Θ≠11 |
H2SO3 | K1=1.54ΓΝ10Θ≠2 | K2=1.02ΓΝ10Θ≠7 |
Θ®4Θ©”–“Μ÷÷Ω…≥δΒγΒγ≥ΊNaΓΣAl/FeSΘ§Βγ≥ΊΙΛΉς ±Na+ΒΡΈο÷ ΒΡΝΩ±Θ≥÷≤Μ±δΘ§≤Δ«“ «”ΟΚ§Na+ΒΡΒΦΒγΙΧΧεΉςΈΣΒγΫβ÷ Θ§“―÷ΣΗΟΒγ≥Ί’ΐΦΪΖ¥”Π ΫΈΣ2Na++FeS+2eΓΣ=Na2S+FeΘ§‘ρΗΟΒγ≥Ί‘Ύ≥δΒγ ±Θ§―τΦΪΖΔ…ζΖ¥”ΠΒΡΈο÷ «____________Θ§Ζ≈Βγ ±ΗΚΦΪΖ¥”Π ΫΈΣ__________________ΓΘ
ΓΨ¥πΑΗΓΩ BC 0.2mol/L ±δ–Γ 1.0ΓΝ10-10mol/L ΘΦ Na2SΓΔFe Na - e- = Na+
ΓΨΫβΈωΓΩ ‘ΧβΖ÷ΈωΘΚ±ΨΧβΩΦ≤ιΤΫΚβ ±ΈοάμΝΩ¥σ–ΓΒΡ±»ΫœΘ§Μ·―ßΤΫΚβΒΡΦΤΥψΘ§”Αœλ―ΈάύΥ°ΫβΒΡ“ρΥΊΚΆ―ΈάύΥ°ΫβΒΡΙφ¬…Θ§»ήΕ»ΜΐΒΡΦΤΥψΘ§Ω…≥δΒγΒγ≥ΊΒΡΙΛΉς‘≠άμΓΘ
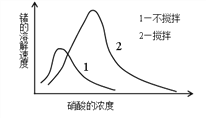
Θ®1Θ©»ίΤς÷–ΖΔ…ζΒΡΖ¥”ΠΈΣ2SO2Θ®gΘ©+O2Θ®gΘ©![]() 2SO3Θ®gΘ©ΓΘAΘ§»τ”“ “ΒΡ»ίΜΐ”κΉσ “œύΒ»Θ§Ήσ “ΚΆ”“ “‘ΎœύΆ§ΧθΦΰ¥οΒΫΒΡΤΫΚβΉ¥Χ§œύΆ§Θ§Κ§”–ΒΡSO2Έο÷ ΒΡΝΩœύΒ»Θ§”“ “‘Ύ¥ΥΤΫΚβ ±ΫΪΧεΜΐΥθ–ΓΈΣ1/2Θ§‘ω¥σ―Ι«ΩΘ§ΤΫΚβœρ’ΐΖ¥”ΠΖΫœρ“ΤΕ·Θ§SO2Έο÷ ΒΡΝΩΦθ…ΌΘ§ΒΎ“Μ¥ΈΤΫΚβ ±Θ§SO2Έο÷ ΒΡΝΩΉσ “ΗϋΕύΘ§Aœν¥μΈσΘΜBΘ§Ά®»κΤχΧεΈ¥Ζ¥”Π«ΑΘ§Ήσ “ΤχΧεΉήΈο÷ ΒΡΝΩΈΣ2mol+1mol+1mol=4molΘ§”“ “ΤχΧεΉήΈο÷ ΒΡΝΩΈΣ2molΘ§Ήσ “»ίΜΐΈΣ”“ “ΒΡΝΫ±ΕΘ§Έ¬Ε»œύΆ§Θ§‘ρΉσ “―Ι«ΩΚΆ”“ ““Μ―υ¥σΘ§Bœν’ΐ»ΖΘΜCΘ§Ήσ “¥”’ΐΖ¥”ΠΩΣ ΦΫ®ΝΔΤΫΚβΘ§Ήσ “ΤΫΚβ ±―Ι«Ω–Γ”ΎΉσ “Τπ Φ―Ι«ΩΘ§”“ “¥”ΡφΖ¥”ΠΩΣ ΦΫ®ΝΔΤΫΚβΘ§”“ “ΤΫΚβ ±―Ι«Ω¥σ”Ύ”“ “Τπ Φ ±―Ι«ΩΘ§Ήσ “”κ”“ “Τπ Φ―Ι«ΩœύΒ»Θ§‘ρΒΎ“Μ¥ΈΤΫΚβ ±Ήσ “ΡΎ―Ι«Ω“ΜΕ®–Γ”Ύ”“ “Θ§Cœν’ΐ»ΖΘΜDΘ§»τ‘Ύ»ίΜΐΈΣ2±ΕΉσ “»ίΜΐΒΡ»ίΤς÷–Τπ Φ≥δ»κ4molSO2ΓΔ2molO2Θ§œύΆ§ΧθΦΰœ¬¥οΒΫΤΫΚβ ±SO2Έο÷ ΒΡΝΩΈΣΉσ “SO2Έο÷ ΒΡΝΩΒΡ2±ΕΘ§¥ρΩΣΜν»ϊœύΒ±”Ύ»ίΜΐΈΣ1.5±ΕΉσ “»ίΜΐΒΡ»ίΤς÷–Τπ Φ≥δ»κ2molSO2ΓΔ1molO2ΓΔ2molSO3Θ®gΘ©ΓΔ1molArΘ§Β»–ß”Ύ»ίΜΐΈΣ1.5±ΕΉσ “»ίΜΐΒΡ»ίΤς÷–Τπ Φ≥δ»κ4molSO2ΓΔ2molO2ΓΔ1molArΘ§œύΕ‘”Ύ2±ΕΉσ “»ίΜΐΒΡ»ίΤςΥθ–ΓΧεΜΐΘ§‘ω¥σ―Ι«ΩΘ§ΤΫΚβœρ’ΐΖ¥”ΠΖΫœρ“ΤΕ·Θ§SO2Έο÷ ΒΡΝΩΦθ–ΓΘ§Φ¥ΒΎΕΰ¥ΈΤΫΚβ ±Θ§SO2ΒΡΉήΈο÷ ΒΡΝΩ±»ΒΎ“Μ¥ΈΤΫΚβ ±Ήσ “SO2Έο÷ ΒΡΝΩΒΡ2±Ε“Σ…ΌΘ§Dœν¥μΈσΘΜ¥πΑΗ―ΓBCΓΘ
2SO3Θ®gΘ©ΓΘAΘ§»τ”“ “ΒΡ»ίΜΐ”κΉσ “œύΒ»Θ§Ήσ “ΚΆ”“ “‘ΎœύΆ§ΧθΦΰ¥οΒΫΒΡΤΫΚβΉ¥Χ§œύΆ§Θ§Κ§”–ΒΡSO2Έο÷ ΒΡΝΩœύΒ»Θ§”“ “‘Ύ¥ΥΤΫΚβ ±ΫΪΧεΜΐΥθ–ΓΈΣ1/2Θ§‘ω¥σ―Ι«ΩΘ§ΤΫΚβœρ’ΐΖ¥”ΠΖΫœρ“ΤΕ·Θ§SO2Έο÷ ΒΡΝΩΦθ…ΌΘ§ΒΎ“Μ¥ΈΤΫΚβ ±Θ§SO2Έο÷ ΒΡΝΩΉσ “ΗϋΕύΘ§Aœν¥μΈσΘΜBΘ§Ά®»κΤχΧεΈ¥Ζ¥”Π«ΑΘ§Ήσ “ΤχΧεΉήΈο÷ ΒΡΝΩΈΣ2mol+1mol+1mol=4molΘ§”“ “ΤχΧεΉήΈο÷ ΒΡΝΩΈΣ2molΘ§Ήσ “»ίΜΐΈΣ”“ “ΒΡΝΫ±ΕΘ§Έ¬Ε»œύΆ§Θ§‘ρΉσ “―Ι«ΩΚΆ”“ ““Μ―υ¥σΘ§Bœν’ΐ»ΖΘΜCΘ§Ήσ “¥”’ΐΖ¥”ΠΩΣ ΦΫ®ΝΔΤΫΚβΘ§Ήσ “ΤΫΚβ ±―Ι«Ω–Γ”ΎΉσ “Τπ Φ―Ι«ΩΘ§”“ “¥”ΡφΖ¥”ΠΩΣ ΦΫ®ΝΔΤΫΚβΘ§”“ “ΤΫΚβ ±―Ι«Ω¥σ”Ύ”“ “Τπ Φ ±―Ι«ΩΘ§Ήσ “”κ”“ “Τπ Φ―Ι«ΩœύΒ»Θ§‘ρΒΎ“Μ¥ΈΤΫΚβ ±Ήσ “ΡΎ―Ι«Ω“ΜΕ®–Γ”Ύ”“ “Θ§Cœν’ΐ»ΖΘΜDΘ§»τ‘Ύ»ίΜΐΈΣ2±ΕΉσ “»ίΜΐΒΡ»ίΤς÷–Τπ Φ≥δ»κ4molSO2ΓΔ2molO2Θ§œύΆ§ΧθΦΰœ¬¥οΒΫΤΫΚβ ±SO2Έο÷ ΒΡΝΩΈΣΉσ “SO2Έο÷ ΒΡΝΩΒΡ2±ΕΘ§¥ρΩΣΜν»ϊœύΒ±”Ύ»ίΜΐΈΣ1.5±ΕΉσ “»ίΜΐΒΡ»ίΤς÷–Τπ Φ≥δ»κ2molSO2ΓΔ1molO2ΓΔ2molSO3Θ®gΘ©ΓΔ1molArΘ§Β»–ß”Ύ»ίΜΐΈΣ1.5±ΕΉσ “»ίΜΐΒΡ»ίΤς÷–Τπ Φ≥δ»κ4molSO2ΓΔ2molO2ΓΔ1molArΘ§œύΕ‘”Ύ2±ΕΉσ “»ίΜΐΒΡ»ίΤςΥθ–ΓΧεΜΐΘ§‘ω¥σ―Ι«ΩΘ§ΤΫΚβœρ’ΐΖ¥”ΠΖΫœρ“ΤΕ·Θ§SO2Έο÷ ΒΡΝΩΦθ–ΓΘ§Φ¥ΒΎΕΰ¥ΈΤΫΚβ ±Θ§SO2ΒΡΉήΈο÷ ΒΡΝΩ±»ΒΎ“Μ¥ΈΤΫΚβ ±Ήσ “SO2Έο÷ ΒΡΝΩΒΡ2±Ε“Σ…ΌΘ§Dœν¥μΈσΘΜ¥πΑΗ―ΓBCΓΘ
Θ®2Θ©ΗυΨί»»Μ·―ßΖΫ≥Χ ΫΘ§ΟΩœϊΚΡ2molNH3ΚΆ1molCO2Θ§Ζ¥”ΠΖ≈≥ω159.5kJ»»ΝΩΘ§Ζ≈≥ω127.6kJ»»ΝΩ ±nΘ®NH3Θ©ΉΣΜ·=![]() =1.6molΘ§nΘ®CO2Θ©ΉΣΜ·=
=1.6molΘ§nΘ®CO2Θ©ΉΣΜ·=![]() =0.8molΘ§ΤΫΚβ ±nΘ®NH3Θ©=2mol-1.6mol=0.4molΓΔnΘ®CO2Θ©=1mol-0.8mol=0.2molΘ§ΤΫΚβ ±cΘ®NH3Θ©=0.2mol/LΓΔcΘ®CO2Θ©=0.1mol/LΘ§ΗΟΈ¬Ε»œ¬Μ·―ßΤΫΚβ≥Θ ΐK=
=0.8molΘ§ΤΫΚβ ±nΘ®NH3Θ©=2mol-1.6mol=0.4molΓΔnΘ®CO2Θ©=1mol-0.8mol=0.2molΘ§ΤΫΚβ ±cΘ®NH3Θ©=0.2mol/LΓΔcΘ®CO2Θ©=0.1mol/LΘ§ΗΟΈ¬Ε»œ¬Μ·―ßΤΫΚβ≥Θ ΐK=![]() =
=![]() =250ΓΘ»τœρ»ίΤς÷–≥δ»κ2.8molNH3ΚΆ1.4molCO2Θ§…η¥”Τπ ΦΒΫΤΫΚβΉΣΜ·CO2Έο÷ ΒΡΝΩ≈®Ε»ΈΣxΘ§”Ο»ΐΕΈ Ϋ
=250ΓΘ»τœρ»ίΤς÷–≥δ»κ2.8molNH3ΚΆ1.4molCO2Θ§…η¥”Τπ ΦΒΫΤΫΚβΉΣΜ·CO2Έο÷ ΒΡΝΩ≈®Ε»ΈΣxΘ§”Ο»ΐΕΈ Ϋ
2NH3Θ®gΘ©+CO2Θ®gΘ©![]() NH2COONH4Θ®sΘ©
NH2COONH4Θ®sΘ©
cΘ®Τπ ΦΘ©Θ®mol/LΘ© 1.4 0.7
cΘ®ΉΣΜ·Θ©Θ®mol/LΘ© 2x x
cΘ®ΤΫΚβΘ©Θ®mol/LΘ© 1.4-2x 0.7-x
![]() =250Θ§ΫβΒΟx=0.6mol/LΘ§ΒΫ¥οΤΫΚβ ±Θ§cΘ®NH3Θ©=1.4mol/L-2
=250Θ§ΫβΒΟx=0.6mol/LΘ§ΒΫ¥οΤΫΚβ ±Θ§cΘ®NH3Θ©=1.4mol/L-2![]() 0.6mol/L=0.2mol/LΓΘ
0.6mol/L=0.2mol/LΓΘ
Θ®3Θ©ΔΌNa2CO3»ή“Κ τ”Ύ«ΩΦν»θΥα―ΈΘ§»ή“Κ÷–OH-»Ϊ≤Ωά¥Ή‘Υ°ΒγάκΘ§Υ°ΒγάκΒΡcΘ®H+Θ©=cΘ®OH-Θ©Θ§œρ¥ΩΦν»ή“Κ÷–Φ”»κ…ΌΝΩΥ°Θ§¥ΌΫχCO32-ΒΡΥ°ΫβΘ§Υ°Ϋβ≤ζ…ζOH-Έο÷ ΒΡΝΩ‘ω¥σΘ§”…”Ύ»ή“ΚΧεΜΐ‘ω¥σΘ§cΘ®OH-Θ©Φθ–ΓΘ§‘ρ”…Υ°Βγάκ≥ωΒΡcΘ®H+Θ©![]() cΘ®OH-Θ©±δ–ΓΓΘ
cΘ®OH-Θ©±δ–ΓΓΘ
ΔΎnΘ®AgNO3Θ©![]() 0.00008V=0.19984VΘ§cΘ®Ag+Θ©ΙΐΝΩ=
0.00008V=0.19984VΘ§cΘ®Ag+Θ©ΙΐΝΩ=![]() =0.09992mol/LΘ§»ή“Κ÷–cΘ®CrO42-Θ©=KspΘ®Ag2CrO4Θ©
=0.09992mol/LΘ§»ή“Κ÷–cΘ®CrO42-Θ©=KspΘ®Ag2CrO4Θ©![]() c2Θ®Ag+Θ©=1
c2Θ®Ag+Θ©=1![]() 10-12
10-12![]() 0.099922=1.0
0.099922=1.0![]() 10-10Θ®mol/LΘ©ΓΘ
10-10Θ®mol/LΘ©ΓΘ
ΔέHCO3-ΒΡΥ°ΫβΤΫΚβΈΣΘΚHCO3-+H2O![]() H2CO3+OH-Θ§HCO3-ΒΡΥ°ΫβΤΫΚβ≥Θ ΐKh=
H2CO3+OH-Θ§HCO3-ΒΡΥ°ΫβΤΫΚβ≥Θ ΐKh=![]() =
=![]() =
=![]() =
=![]() =2.3
=2.3![]() 10-8
10-8![]() 5.6
5.6![]() 10-11Θ§HCO3-ΒΡΥ°Ϋβ≥ΧΕ»¥σ”ΎHCO3-ΒΡΒγάκ≥ΧΕ»Θ§NaHCO3»ή“Κ≥ Φν–‘ΘΜH2CO3ΒΡK1
10-11Θ§HCO3-ΒΡΥ°Ϋβ≥ΧΕ»¥σ”ΎHCO3-ΒΡΒγάκ≥ΧΕ»Θ§NaHCO3»ή“Κ≥ Φν–‘ΘΜH2CO3ΒΡK1![]() H2SO3ΒΡK2Θ§HCO3-ΒΡΥ°ΫβΡήΝΠ
H2SO3ΒΡK2Θ§HCO3-ΒΡΥ°ΫβΡήΝΠ![]() SO32-ΒΡΥ°ΫβΡήΝΠΘ§0.1mol/LNaHCO3»ή“ΚΒΡpH÷Β
SO32-ΒΡΥ°ΫβΡήΝΠΘ§0.1mol/LNaHCO3»ή“ΚΒΡpH÷Β![]() 0.1mol/LNa2SO3»ή“ΚΒΡpH÷ΒΓΘ
0.1mol/LNa2SO3»ή“ΚΒΡpH÷ΒΓΘ
Θ®4Θ©Βγ≥Ί’ΐΦΪΖ¥”Π ΫΈΣ2Na++FeS+2e-=Na2S+FeΘ§Βγ≥Ί≥δΒγ ±―τΦΪΖ¥”Π ΫΈΣNa2S+Fe-2e-=FeS+2Na+Θ§≥δΒγ ±―τΦΪΖΔ…ζΖ¥”ΠΒΡΈο÷ «Na2SΚΆFeΓΘΒγ≥Ί’ΐΦΪΖ¥”Π ΫΈΣ2Na++FeS+2e-=Na2S+FeΘ§’ΐΦΪœϊΚΡNa+Θ§Βγ≥ΊΙΛΉς ±Na+ΒΡΈο÷ ΒΡΝΩ±Θ≥÷≤Μ±δΘ§‘ρΒγ≥ΊΗΚΦΪΖ¥”Π ΫΈΣNa-e-=Na+ΓΘ



| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ–η“Σ≈δ÷Τ500 mL 0.5 molΓΛLΘ≠1«β―θΜ·ΡΤ»ή“ΚΘ§Ψ≠≤βΕ® ΒΦ Υυ≈δ«β―θΜ·ΡΤ»ή“ΚΒΡ≈®Ε»ΈΣ0.45 molΓΛLΘ≠1ΓΘΩ…ΡήΒΡ‘≠“ρ «(ΓΓΓΓ)
A. ΉΣ“Τ ±»ή“ΚΟΜ”–ά以÷Ν “Έ¬ B. »ίΝΩΤΩΟΜ”–ΚφΗ…
C. ≥ΤΝΩ«β―θΜ·ΡΤΙΧΧε ±μά¬κΖ≈Ζ¥ΝΥ D. Ε®»ί ±―ω ”ΕΝ ΐ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ≤Μ≥ ÷ήΤΎ–‘±δΜ·ΒΡ «
A. ‘≠Ή”ΑκΨΕ B. ‘≠Ή”–ρ ΐ
C. ‘ΣΥΊ÷ς“ΣΜ·ΚœΦέ D. ‘ΣΥΊ‘≠Ή”ΒΟ ßΒγΉ”ΒΡΡήΝΠ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ‘≠Ή”–ρ ΐ‘Ύ ΐ÷Β…œΒ»”Ύ
A. ΗΟ‘≠Ή”ΒΡ÷ ΝΩ ΐ B. ‘≠Ή”ΚΥΡΎ÷–Ή” ΐ
C. ‘≠Ή”ΚΥΡΎΒΡ÷ Ή” ΐ D. ΗΟ‘ΣΥΊΒΡœύΕ‘‘≠Ή”÷ ΝΩ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΙΊ”ΎΑ±ΒΡœ¬Ν––π ω÷–Θ§≤Μ’ΐ»ΖΒΡ «Θ® Θ©
A. Β―ι “÷ΤΑ±ΤχΒΡΖΫΖ® «Φ”»»NH4Cl
B.“ΚΑ± «¥ΩΨΜΈο
C.Α±“Ή“ΚΜ·Θ§“ρ¥ΥΩ…”Οά¥Ής÷ΤάδΦΝ
D.Α±ΦΪ“Ή»ή”ΎΥ°Θ§“ρ¥ΥΩ…”Οά¥Ής≈γ»Σ Β―ι
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ’ύ «÷Ί“ΣΒΡœΓ»±’Ϋ¬‘Ή ‘¥Θ§ΙψΖΚ”Π”Ο”Ύ÷ΎΕύΙζΖάΨϋΙΛΦΑΟώ”ΟΝλ”ρΘ§ τ”ΎΈ“Ιζ’Ϋ¬‘ ’¥ΔΫπ τΓΘΡ≥ΩΤ―–ΩΈΧβ≤…”ΟΒΡΧα»Γ’ύΦΦ θ¬ΖœΏΈΣΘΚΒΆΤΖΈΜ’ύΨΪΩσ-Θ®¥Έ―«ΝΉΥαΡΤ»»ΜΙ‘≠-’φΩ’Μ”ΖΔΗΜΦ·Θ©-Μ”ΖΔ≤ζΈοΗΏΤΖΈΜΜΙ‘≠’ύΨΪΩσ-Φν―θΜ·‘Λ¥Πάμ-―ΈΥα’τΝσΧα¥Ω-ΗΏ¥ΩΥΡ¬»Μ·’ύ-ΗΏ¥ΩΕΰ―θΜ·’ύΓΘ

Θ®1Θ©‘Ύ÷ήΤΎ±μ÷–Ϋπ τ”κΖ«Ϋπ τΒΡΖ÷Ϋγ¥ΠΘ§Ω…“‘’“ΒΫΑκΒΦΧε≤ΡΝœΘ§»γSiΓΔ Β»Θ§ΑκΒΦΧεΤςΦΰΒΡ―–÷Τ’ΐ «ΩΣ Φ”Ύ Θ§Κσά¥ΖΔ’ΙΒΫ―–÷Τ”κΥϋΆ§ΉεΒΡ ΓΘ»ΐ÷÷‘ΣΥΊ“ά¥Έ «_______Θ®Χν±ξΚ≈Θ©ΓΘ
aΘ°Ge Si Ge
bΘ°Ge Ge Si
cΘ°C Si Ge
Θ®2Θ©«κ≈δΤΫ¥Έ―«ΝΉΥαΡΤ»»ΜΙ‘≠Ζ¥”ΠΒΡΜ·―ßΖΫ≥Χ Ϋ≤Δ‘Ύά®Κ≈ΡΎΉΔΟςΖ¥”ΠΧθΦΰΘΚ
___NaH2PO2ΓΛH2O+GeO2 ![]() ___Na4P2O7+___H2O+___GeOΓϋ+___H3PO4Θ§_____________
___Na4P2O7+___H2O+___GeOΓϋ+___H3PO4Θ§_____________
Θ®3Θ©ΗΏΤΖΈΜΜΙ‘≠’ύΨΪΩσΦν―θΜ·‘Λ¥ΠάμΙΐ≥ΧΒΡ≤ζΈο «’ύΥαΡΤΘ§«κ–¥≥ωΗΟΙΐ≥ΧΒΡΜ·―ßΖ¥”ΠΖΫ≥Χ ΫΘΚ____________________________________________
Θ®4Θ©ΗΏ¥ΩΕΰ―θΜ·’ύΚ§ΝΩ≤…”ΟΒβΥαΦΊΒΈΕ®Ζ®Ϋχ––Ζ÷ΈωΓΘ≥Τ»Γ3.600gΗΏ¥ΩΕΰ―θΜ·’ύ―υΤΖΘ§≤…”Ο«β―θΜ·ΡΤ‘ΎΒγ¬·…œ»ή―υΘ§¥Έ―«ΝΉΥαΡΤΦ”»»ΜΙ‘≠Θ§»ΜΚσ“‘ΒμΖέΈΣ÷Η ΨΦΝΘ§”ΟΒβΥαΦΊ±ξΉΦ»ή“ΚΘ®0.6000mol/LΘ©ΒΈΕ®Θ§œϊΚΡΒΡΒβΥαΦΊΧεΜΐΈΣ19.00mLΓΘ[20Γφ“‘œ¬Θ§¥Έ―«ΝΉΥαΡΤ≤ΜΜα±ΜΒβΥαΦΊΚΆΒβ―θΜ·]
ΔΌΒΈΕ®÷’ΒψΒΡœ÷œσ «_____________________________ΓΘ
ΔΎ¥Υ―υΤΖ÷–Εΰ―θΜ·’ύΚ§ΝΩ «_________ΓΘΘ®±ΘΝτΥΡΈΜ”––ß ΐΉ÷Θ©
Θ®5Θ©”Ο«βΤχΜΙ‘≠GeO2Ω…÷ΤΒΟΫπ τ’ύΓΘΤδΖ¥”Π»γœ¬ΘΚ
GeO2+ H2= GeO+ H2O ΔΌ
GeO+ H2= Ge+ H2O ΔΎ
GeO2+ 2H2= Ge+ 2H2O Δέ
Ζ¥”Π ΫΔέΠΛH=+13750 kJ/mol Θ§ΠΛS=+15600J/(KΓΛmolΘ©Θ§‘ρΜΙ‘≠Ζ¥”ΠΒΡΈ¬Ε»“ΜΑψΩΊ÷Τ‘Ύ_________ΓφΖΕΈßΡΎΓΘ[“―÷ΣGeO‘Ύ700ΓφΜα…ΐΜΣΘ§T(K)=t(Γφ)+273]
Θ®6Θ©’ύ‘ΎœθΥα÷–ΒΡ»ήΫβΥΌΕ» ήœθΥα≈®Ε»ΓΔΫΝΑηΥΌΕ»ΓΔΈ¬Ε»Β»“ρΥΊ”ΑœλΓΘ»γΆΦΘ§’ύ»ήΫβΥΌΕ»”–“ΜΉν¥σ÷ΒΘ§œθΥαΒΡ≈®Ε»–Γ”Ύ¥Υ÷Β ±Θ§Υφ≈®Ε»‘ωΦ”»ήΫβΥΌΕ»‘ωΦ”Θ§Ζ¥÷°ΫΒΒΆΘ§’β «”…”ΎœθΥα≈®Ε»ΗΏ ±_________Φ”ΨγΥυ÷¬ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ”ΟΚτΈϋ“÷÷ΤΦΝ¥Πάμ»ΥΧεΚλœΗΑϊΘ§œ¬Ν–Έο÷ Έϋ ’ΝΩœ‘÷χΦθ…ΌΒΡ“ΜΉι «Θ® Θ©
A.  B.
B. 
C.  D.
D. 
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬Ν–άκΉ”Ήι‘Ύ “Έ¬œ¬Ω…Ρή¥σΝΩΙ≤¥φΒΡ «Θ® Θ©
A. pHΘΫ2ΒΡ»ή“ΚΘΚHCO3-ΓΔNa+ΓΔClO-ΓΔNO3-
B. 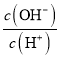 ΘΫ106ΒΡ»ή“ΚΘΚAl3+ΓΔNH4+ΓΔCl-ΓΔS2-
ΘΫ106ΒΡ»ή“ΚΘΚAl3+ΓΔNH4+ΓΔCl-ΓΔS2-
C. Υ°Βγάκ≥ωΒΡc(H+)ΘΫ10-4 mol/LΒΡ»ή“ΚΘΚNa+ΓΔK+ΓΔSO42-ΓΔCO32-
D. Ι ·»ο≥ Κλ…ΪΒΡ»ή“ΚΘΚNH4+ΓΔNO3-ΓΔAlO2-ΓΔI-
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ–¬‘σή‘άρ»© «“Μ÷÷ΟϊΙσΒΡœψΝœ.ΤδΚœ≥…¬ΖœΏ»γœ¬ΘΚ
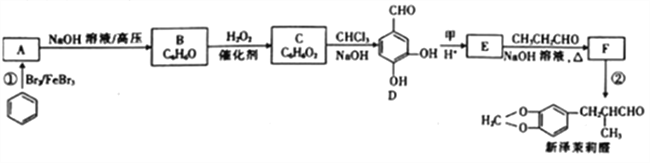
“―÷Σ:ΔΌRCHO+R'CH2CHO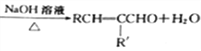
ΔΎ
Θ®1Θ©“―÷ΣΦΉΒΡœύΕ‘Ζ÷Ή”÷ ΝΩΈΣ30Θ§ΦΉΒΡΫαΙΙΦρ ΫΈΣ____ΓΘE÷–Κ§―θΙΌΡήΆ≈ΒΡΟϊ≥Τ «____ΓΘ
Θ®2Θ©Ζ¥”ΠΔΎΒΡΖ¥”Πάύ–Ά «____ ΓΘ
Θ®3Θ©–¥≥ωΖ¥”ΠΔΌΒΡΜ·―ßΖΫ≥Χ Ϋ:_________________ΓΘ
Θ®4Θ©ΖΦœψΉεΜ·ΚœΈοG”κEΜΞΈΣΆ§Ζ÷“λΙΙΧεΘ§1molGΡή”κΉψΝΩNaHCO3»ή“ΚΖ¥”Π≤ζ…ζ1molΤχΧεΘ§«“GΡήΖΔ…ζ“χΨΒΖ¥”ΠΓΘ‘ρGΒΡΫαΙΙ”–______÷÷ΓΘΤδ÷–“Μ÷÷ΫαΙΙ±ΫΜΖ…œΒΡ“Μ¬»¥ζΈο”–ΝΫ÷÷Θ§«“±Μ―θΜ·ΚσΡή”κCΖ¥”Π…ζ≥…ΗΏΖ÷Ή”Μ·ΚœΈοΘ§–¥≥ωΗΟΗΏΖ÷Ή”Μ·ΚœΈοΒΡΫαΙΙΦρ Ϋ:_______ΓΘ
Θ®5Θ©ΫαΚœ“―÷ΣΔΌΘ§…ηΦΤ“‘““¥ΦΚΆ±ΫΦΉ»©![]() ΈΣ‘≠Νœ(ΈόΜζ ‘ΦΝ»Έ―Γ)÷Τ±Η
ΈΣ‘≠Νœ(ΈόΜζ ‘ΦΝ»Έ―Γ)÷Τ±Η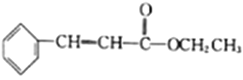 ΒΡΚœ≥…¬ΖœΏ(”ΟΫαΙΙΦρ Ϋ±μ Ψ”–ΜζΈοΘ§”ΟΦΐΆΖ±μ ΨΉΣΜ·ΙΊœΒΘ§ΦΐΆΖ…œΉΔΟς ‘ΦΝΚΆΖ¥”ΠΧθΦΰ):__________________ΓΘ
ΒΡΚœ≥…¬ΖœΏ(”ΟΫαΙΙΦρ Ϋ±μ Ψ”–ΜζΈοΘ§”ΟΦΐΆΖ±μ ΨΉΣΜ·ΙΊœΒΘ§ΦΐΆΖ…œΉΔΟς ‘ΦΝΚΆΖ¥”ΠΧθΦΰ):__________________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΙζΦ ―ß–Θ”≈―Γ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com