
【题目】![]() 是重要的工业原料,铀浓缩一直为国际社会关注。下列说法正确的是
是重要的工业原料,铀浓缩一直为国际社会关注。下列说法正确的是
A. ![]() 原子核中含有92个中子 B.
原子核中含有92个中子 B. ![]() 原子核外有143个电子
原子核外有143个电子
C. ![]() 与
与![]() 互为同位素 D.
互为同位素 D. ![]() 与
与![]() 为同一核素
为同一核素
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:
【题目】已知:① ②
②![]()
现用丙二酸等物质合成含有小环的有机物K,合成路线如下:
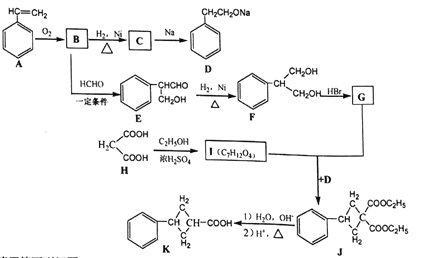
请回答下列问题:
(1)A的名称是_______,E中含氧官能团的名称是_____。
(2)B→C 的反应类型是_______ ,F→G的反应类型是____。
(3)G和I的结构简式分别为_______、________。
(4)写出F和H在一定条件下合成高分子化合物的化学反应方程式:_______。
(5)同时满足下列条件的E的同分异构体数目为________种。
① 能发生银镜反应;② 能发生水解反应,其水解产物之一能与FeCl3溶液发生显色反应。
(6)请写出以H2C=CHCH2Br为原料制备![]() ,参考本题题干写出制备的合成线路流程图(无机试剂任选)。________
,参考本题题干写出制备的合成线路流程图(无机试剂任选)。________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、按要求填空:
(1)32 g CH4,其摩尔质量为_______,约含有____摩电子,在标准状况下所占的体积约为____L。
(2)等体积等物质的量浓度的Ca(OH)2溶液与NaHCO3溶液混合,离子方程式为:______。
(3)H++HCO3-=H2O+CO2↑对应的一个化学方程式________________________。
(4)制备氢氧化铁胶体的离子方程式________________。
Ⅱ、现有以下物质:
①NaCl固体 ②液态SO3 ③液态的醋酸 ④汞 ⑤BaSO4固体 ⑥蔗糖(C12H22O11) ⑦酒精(C2H5OH) ⑧熔化的KNO3 ⑨盐酸。请回答下列问题(填序号)。
(1)以上物质中能导电的是__________________。
(2)以上物质属于电解质的是_________________。
(3)以上物质中属于非电解质的是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】混合物分离和提纯常用下图装置进行,按要求回答下列问题:
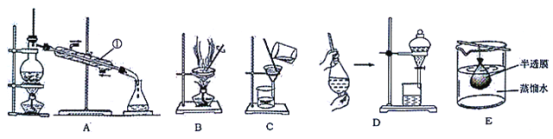
(1)仪器①的名称__________。
(2)明胶是水溶性蛋白质混合物,溶于水形成胶体。分离明胶的水溶液与Na2CO3、Na2SO4的混合溶液应选用装置的为(用上图字母填写)_____。如何证明SO42-已分离出来_____。
(3)在装置D中加入10 mL碘水,然后再注入4 mL CCl4,盖好玻璃塞,按操作规则反复振荡后静置观察到的现象是:___________________________________。操作完毕后,为得到碘并回收CCl4可用________法。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铍铜是力学、化学综合性能良好的合金,广泛应用于制造高级弹性元件。以下是从某废旧铍铜元件(含BeO25%、CuS71%、少量FeS和SiO2)中回收铍和铜两种金属的流程

已知:I.铍、铝元素处于周期表中的对角线位置,化学性质相似
Ⅱ.常温下: Ksp[Cu(OH)2]=2.2×10-20 Ksp[Fe(OH)3]=4.0×10-38 K sp[Mn(OH)2]=2.1×10-13
(1)滤液A的主要成分除NaOH外,还有______________ (填化学式)
写出反应I中含铍化合物与过量盐酸反应的离子方程式____________________________
(2)①溶液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,选择合理步骤并排序______________。
a加入过量的 NaOH b.通入过量的CO2 c加入过量的氨水
d.加入适量的HCl e.过滤 f洗涤
②从BeCl2溶液中得到BeCl2固体的操作是____________________________。
(3)①MnO2能将金属硫化物中的硫元素氧化为单质硫,写出反应Ⅱ中CuS发生反应的化学方程式________________________________________________________。
②若用浓HNO3溶解金属硫化物,缺点是______________ (任写一条)。
(4)溶液D中含c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.01mol·L-1,逐滴加入稀氨水调节pH可依次分离,首先沉淀的是______________ (填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH值大于______________。
(5)取铍铜元件1000g,最终获得Be的质量为81g,则产率是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图甲池和乙池中的四个电极都是铂电极,乙池溶液分层,上层溶液为盐溶液,呈中性。请根据图示判断下列有关说法正确的是:( )
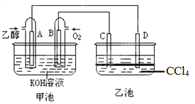
A. 甲池的电解池,乙池是原电池
B. 通入乙醇的铂电极反应式为C2H5OH+16OH-+12e-=2CO32-+11H2O
C. 反应一段时间后,两池溶液的pH均未变化
D. 假如乙池中加入NaI溶液,则在乙池反应过程中,可以观察到C电极周围的溶液呈现棕黄色,反应完毕后,用玻璃棒搅拌溶液,则下层溶液呈现紫红色,上层接近无色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题
(1)向煮沸的蒸馏水中逐滴加入饱和FeCl3溶液,继续煮沸至溶液呈红褐色,停止加热,可制得Fe(OH)3胶体,制取Fe(OH)3胶体的离子方程式为_______________________。
(2)Ca(OH)2的电离方程式为_______________。
(3)现有下列物质:①干冰②NaHCO3晶体③氨水④纯醋酸⑤FeCl3溶液⑥铜⑦蔗糖⑧熔化的NaCl,其中属于非电解质的是___________(填序号,下同),属于强电解质的有____________,属于弱电解质的有________________,能导电的物质有________________。
(4)若有一表面光滑的塑料小球悬浮于Ba(OH)2溶液中央,如图所示。向该烧杯里缓缓注入与Ba(OH)2溶液等密度的稀H2SO4至恰好完全反应。在此实验过程中,此实验中观察到的现象有___________________________________________。
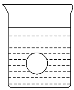
(5)下列说法正确的是_________________。
①碱性氧化物一定是金属氧化物;
②酸性氧化物一定是非金属氧化物;
③乳浊液静止后分层;
④Mg2+、SO42-、Fe3+、X四种离子以物质的量之比1:2:1:1大量共存于同一水溶液中,X可能是NO3﹣;
⑤碳酸钙是强电解质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com