
【题目】铍铜是力学、化学综合性能良好的合金,广泛应用于制造高级弹性元件。以下是从某废旧铍铜元件(含BeO25%、CuS71%、少量FeS和SiO2)中回收铍和铜两种金属的流程

已知:I.铍、铝元素处于周期表中的对角线位置,化学性质相似
Ⅱ.常温下: Ksp[Cu(OH)2]=2.2×10-20 Ksp[Fe(OH)3]=4.0×10-38 K sp[Mn(OH)2]=2.1×10-13
(1)滤液A的主要成分除NaOH外,还有______________ (填化学式)
写出反应I中含铍化合物与过量盐酸反应的离子方程式____________________________
(2)①溶液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,选择合理步骤并排序______________。
a加入过量的 NaOH b.通入过量的CO2 c加入过量的氨水
d.加入适量的HCl e.过滤 f洗涤
②从BeCl2溶液中得到BeCl2固体的操作是____________________________。
(3)①MnO2能将金属硫化物中的硫元素氧化为单质硫,写出反应Ⅱ中CuS发生反应的化学方程式________________________________________________________。
②若用浓HNO3溶解金属硫化物,缺点是______________ (任写一条)。
(4)溶液D中含c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.01mol·L-1,逐滴加入稀氨水调节pH可依次分离,首先沉淀的是______________ (填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH值大于______________。
(5)取铍铜元件1000g,最终获得Be的质量为81g,则产率是______________。
【答案】 Na2SiO3、Na2BeO2 BeO22-+4H+=Be2++2H2O cefd 蒸发结晶时,向溶液中持续通入氯化氢气体 MnO2+CuS+2H2SO4=S↓+MnSO4+CuSO4+2H2O 产生污染环境的气体(合理即可) Fe3+ 4 90%
【解析】考查化学工艺流程,(1)旧铍铜原件的成分BeO、CuS、FeS、SiO2,根据信息I,BeO属于两性氧化物,CuS不与氢氧化钠溶液反应,FeS不与氢氧化钠反应,SiO2属于酸性氧化物,能与氢氧化钠溶液反应,因此滤液A中主要成分是NaOH、Na2SiO3、Na2BeO2;根据信息I,BeO2-与过量盐酸反应的离子方程式为 BeO22-+4H+=Be2++2H2O;(2)利用Be元素、铝元素化学性质相似,向溶液C中先加入过量的氨水,生成Be(OH)2沉淀,然后过滤、洗涤,再加入适量的HCl,生成BeCl2,合理步骤是cefd;②为了抑制Be2+的水解,因此需要在HCl的氛围中对BeCl2溶液蒸发结晶;(3)①根据信息,CuS中S转化为S单质,MnO2中Mn被还原为Mn2+,根据化合价升降法进行配平,其化学反应方程式为MnO2+CuS+2H2SO4=S↓+MnSO4+CuSO4+2H2O ;②用浓硝酸作氧化剂,HNO3被还原成NO2,NO2有毒污染环境;(4)三种金属阳离子出现沉淀,根据浓度商与Ksp的关系,Cu2+转化成沉淀,c(OH-)= mol·L-1,Fe3+转化成沉淀,c(OH-)=
mol·L-1,Fe3+转化成沉淀,c(OH-)=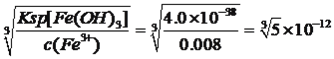 mol·L-1,Mn2+转化成沉淀,c(OH-)=
mol·L-1,Mn2+转化成沉淀,c(OH-)=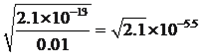 mol·L-1,因此首先沉淀的是Fe3+,为使Cu2+沉淀,此时c(OH-)=1×10-10mol·L-1,c(H+)=10-14/10-10=10-4mol·L-1,即pH=4,当pH>4时,Cu2+出现沉淀;(5)混合物中BeO的质量为1000×25%=250g,理论上得到Be的物质的量为250/25mol=10mol,实际得到Be物质的量为81/9mol=9mol,产率是9/10×100%=90%。
mol·L-1,因此首先沉淀的是Fe3+,为使Cu2+沉淀,此时c(OH-)=1×10-10mol·L-1,c(H+)=10-14/10-10=10-4mol·L-1,即pH=4,当pH>4时,Cu2+出现沉淀;(5)混合物中BeO的质量为1000×25%=250g,理论上得到Be的物质的量为250/25mol=10mol,实际得到Be物质的量为81/9mol=9mol,产率是9/10×100%=90%。


 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案科目:高中化学 来源: 题型:
【题目】金属钠是在1807年通过电解氢氧化钠制得的,这个原理应用于工业生产,约在1891年才获得成功。1921年实现了电解氯化钠制钠的工业方法,其反应原理是:2NaCl(熔融)![]() 2Na+Cl2↑。回答下列有关单质钠的问题:
2Na+Cl2↑。回答下列有关单质钠的问题:
(1)下列各项中属于保存金属钠的正确方法是____。
A.放在棕色瓶中 B.放在细沙中C.放在水中 D.放在煤油中
(2)将一小块钠放在水平放置的试管中部,用酒精灯加热充分反应(如图Ⅰ所示),请写出该反应的化学方程式____________,生成物的颜色为____。将该试管冷却后直立,滴加几滴水(如图Ⅱ所示),发生反应的化学方程式为____________,检验该反应产生的气体的方法是________________。

(3)Na、Na2O、Na2O2、NaOH久置空气中最终都是变为____________(填化学式);过氧化钠与CO2反应的化学方程式__________________________。因此,过氧化钠可作为呼吸面具和潜水艇的氧气来源。
(4)一小块金属钠投入CuCl2溶液中,发生反应的方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生物界和非生物界具有统一性是因为
A. 构成细胞的各种化合物在非生物中都存在
B. 生物界和非生物界都具有新陈代谢
C. 构成细胞的无机物在非生物界是都存在
D. 构成细胞的各种化学元素在无机自然界中都能找到
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是重要的工业原料,铀浓缩一直为国际社会关注。下列说法正确的是
是重要的工业原料,铀浓缩一直为国际社会关注。下列说法正确的是
A. ![]() 原子核中含有92个中子 B.
原子核中含有92个中子 B. ![]() 原子核外有143个电子
原子核外有143个电子
C. ![]() 与
与![]() 互为同位素 D.
互为同位素 D. ![]() 与
与![]() 为同一核素
为同一核素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.3.4gNH3中含有的氢原子数为0.6NAB.0.5mol/LNa2CO3溶液中含有的Na+数为NA
C.标准状况下,11.2LH2O含有的原子数为1.5NAD.常温常压下,22.4L臭氧所含原子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4 ℃下,把质量A g摩尔质量为M g·mol-1的可溶性盐RCln 溶解在V mL水中,恰好形成该温度下的饱和溶液,密度为ρ g·cm-3,下列关系式错误的是
A. 溶质的质量分数ω=A/(A+V)×100%
B. 溶质的物质的量浓度c=1 000ρ A/(MA+MV) mol·L-1
C. 该温度下此盐的溶解度S=100A/V g
D. 1 mL该溶液中n(Cl-)=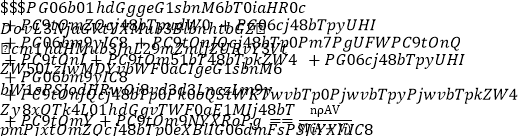 mol
mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将13.0 g锌投入250mL某浓度的盐酸中,锌和盐酸恰好完全反应。求:
(1)反应中生成的H2在标准状况下的体积。__
(2)所用盐酸中HCl的物质的量浓度。_____________
(3)需用多少体积的36.5%的浓盐酸(ρ =1.20 g/mL)来配置上述盐酸。_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:2Zn(s) + O2(g) =2ZnO(s) ΔH1=-702.2kJ/mol
Hg(l) + ![]() O2(g) =HgO(s) ΔH2=-90.7kJ/mol
O2(g) =HgO(s) ΔH2=-90.7kJ/mol
由此可知Zn(s) + HgO(s) = ZnO(s) + Hg(l)的ΔH3 ,其中ΔH3的值是( )
A. -260.4 kJ/mol B. -254.6 kJ/mol
C. -438.9 kJ/mol D. -441.8 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com