
【题目】用下图表示的一些物质或概念间的从属关系中正确的是
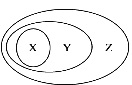
X | Y | Z | |
A | 水 | 单质 | 纯净物 |
B | 非金属氧化物 | 酸性氧化物 | 氧化物 |
C | 电解质 | 化合物 | 纯净物 |
D | 化合反应 | 氧化还原反应 | 化学反应 |
A. A B. B C. C D. D
【答案】C
【解析】
A、同种元素组成的纯净物为单质;
B、氧化物根据性质分为酸性氧化物、碱性氧化物和两性氧化物;根据组成分金属氧化物和非金属氧化物;
C、纯净物分为单质和化合物,化合物根据在水溶液或熔融状态下是否导电,可分为电解质和非电解质两类;
D、化学反应按基本反应类型分化合、分解、置换、复分解反应,按化合价是否变化分氧化还原反应和非氧化还原反应。
A、同种元素组成的纯净物为单质,水不属于单质,故A错误;
B、非金属氧化物有些不是酸性氧化物,如CO等气体,故B错误;
C、纯净物包括单质和化合物两种,在水溶液或熔融状态下能导电的化合物属于电解质,所以C选项是正确的;
D、化合反应有些不属于氧化还原反应,如二氧化碳和水反应生成碳酸,故D错误。
所以C选项是正确的。


科目:高中化学 来源: 题型:
【题目】按要求回答:
(1)Fe2O3+2Al![]() Al2O3+2Fe,在该反应中________元素的化合价升高,该元素的原子____电子(得到或失去),_____________是氧化剂,______________是还原剂,________是还原产物,________是氧化产物。(填化学式)
Al2O3+2Fe,在该反应中________元素的化合价升高,该元素的原子____电子(得到或失去),_____________是氧化剂,______________是还原剂,________是还原产物,________是氧化产物。(填化学式)
(2)标出下列化合物中指定元素的化合价。
KMnO4中Mn元素的化合价__________,KClO3中Cl元素的化合价__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种突破传统电池设计理念的镁-锑液态金属储能电池的工作原理如图所示,该电池所用液体密度不同,在重力作用下分三层,工作时中间层熔融盐的组成及浓度不变。下列说法不正确的是( )

A. 放电时,Mg(液)层的质量减小
B. 放电时正极反应为Mg2++2e-=Mg
C. 该电池充电时,Mg-Sb(液)层发生还原反应
D. 该电池充电时,Cl-向中下层界面处移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气及其化合物在生产生活中有重要的应用。
(1)可用O2将HCl转化为Cl2:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)。已知相关化学键的键能如下表所示
化学键 | H-Cl | O=O | Cl – Cl | H-O |
E(kJ·mol-1 | a | b | c | d |
则该反应的△H=______________。(用含a、b、c、d的代数式表示)
(2)氯气是有机合成中的重要试剂,丙烯(CH2=CHCH3)和Cl2在一定条件下发生如下反应: CH2=CHCH3 (g)+Cl2(g) ![]() CH2=CHCH2Cl(g)+HCl(g)。一定压强下,该反应在不同温度、不同投料比时,达平衡时Cl2的转化率如图所示(T12< T3)
CH2=CHCH2Cl(g)+HCl(g)。一定压强下,该反应在不同温度、不同投料比时,达平衡时Cl2的转化率如图所示(T12< T3)
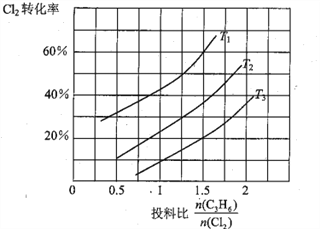
①该反应的△H______________0(填“>”或“<”)
②下列措施能增大丙烯的平衡转化率的是______________ (填标号)。
A.降低温度 B.减小容器的体积
C.使用新型催化剂 D.从容器中移走氯化氢
③T1时,在容积为5L的密闭容器中充入0.15mol丙烯和0.10 molCl2,10min时达到平衡,则v(Cl2)为______________mol·〔L·min)-1,平衡常数K为______________,保持温度不变,减小投料比![]() ,K值将______________ (填“增大”“减小”或“不变”);若起始时向该容器中充入0.30mol丙烯、0.20 molCl2、0.15 mol CH2=CHCH2Cl和0.30 molHCl,判断反应进行的方向并说明理由____________________________。
,K值将______________ (填“增大”“减小”或“不变”);若起始时向该容器中充入0.30mol丙烯、0.20 molCl2、0.15 mol CH2=CHCH2Cl和0.30 molHCl,判断反应进行的方向并说明理由____________________________。
④上述反应在低于某温度时,CH2=CHCH2Cl的产率快速下降,可能的原因是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下①9.6gCH4 ②1molHCl分子 ③17.92 L H2S ④2.408×1023个NH3分子。则
A. 体积:②>③>④>① B. 密度:②>③>①>④
C. 质量:②>③>④>① D. H原子个数:①>③>④>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是CO2电催化还原为CH4的工作原理示意图。下列说法正确的是
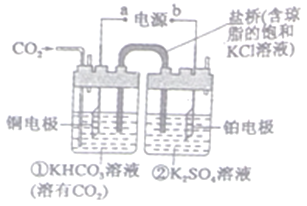
A. 该过程是化学能转化为电能的过程
B. 一段时间后,①池中n(KHCO3)不变
C. 一段时间后,②池中溶液的pH不变
D. 铜电极的电极反应式为9CO2+6H2O+8e-=CH4+8HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁的重要化合物高铁酸钾(K2FeO4)是一种新型饮用水消毒剂,具有很多优点。而且高铁电池的研制也在进行中。如图1是高铁电池的模拟实验装置:

(1)该电池放电时正极的电极反应式为_______________________________;若维持电流强度为1A,电池工作10 min ,理论消耗Zn ___________g(已知F=96500 C/mol)。
(2)图2为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有______________________________________。
(3)高铁酸钾生产方法之二是在强碱性介质中用KClO氧化Fe(OH)3生成高铁酸钾,该反应的离子方程式为_______________________________________。
(4)K2FeO4能消毒、净水的原因________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签上的部分内容如右图所示。利用标签所提供的信息,计算该注射液中葡萄糖的物质的量浓度为____________ (保留两位有效数字);

(2)检查人的血液中葡萄糖(简称血糖)的含量,参考指标常以两种计量单位表示,即“mmol/L”和“mg/dL”(1L=10dL)。以“mmol/L”表示时,人的血糖正常值在3.61~6.11 mmol/L 之间。若某人的血糖检查结果为92mg/dL,他的血糖正常吗?_________ (填“正常”或“不正常”)
Ⅱ.现有0.270kg质量分数为10%的CuCl2溶液,计算
(1)溶液中CuCl2的物质的量为___________;
(2)要将溶液中的Cl-完全沉淀,需加入1.0 mol/L的AgNO3溶液_______mL;
(3)要将溶液中的铜完全置换出来,需加入Fe 的质量为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com