
【题目】现用固体KOH配制0.1mol/L 的KOH溶液 480mL,回答下列问题:
(1)配制过程中需要用到的玻璃仪器有烧杯,玻璃棒,量筒,胶头滴管,____________。
(2)需要用托盘天平称量_______gKOH固体。
(3)如果在定容时仰视操作,则所配得溶液的浓度_____0.1mol/L(填> , = , <)容量瓶不干燥,有一定的水分,则所配得溶液的浓度_____0.1mol/L(填> , = , <)
(4)若所用的固体KOH中混有NaOH,则所配得溶液的c(OH-)浓度______0.1mol/L (填> , = , <)。
【答案】500mL的容量瓶 2.8 < = >
【解析】
(1)配制0.1mol/L 的KOH溶液 480mL,需选用500mL的容量瓶,根据实验步骤选择仪器;
(2)根据m=cVM计算;
(3)根据c=![]() ×
×![]() 进行判断;
进行判断;
(4)NaOH的摩尔质量小于KOH,相同质量时,NaOH含有的n(OH-)大。
(1)配制0.1mol/L 的KOH溶液 480mL,需选用500mL的容量瓶,根据实验步骤计算、称量、溶解、冷却、移液、洗涤、定容、摇匀,需要的仪器有天平、量筒、烧杯、玻璃棒、500mL的容量瓶、胶头滴管,则玻璃仪器缺少500mL的容量瓶;
(2)配置500mL溶液,需要KOH的质量为=0.1mol/L×0.5L×56g/mol=2.8g;
(3)定容时仰视操作,导致溶液的体积大于500mL,则配置溶液的浓度小于0.1mol/L;容量瓶不干燥,有一定量的水,对溶液的溶质及体积无影响,则溶液浓度为0.1mol/L;
(4)所用的固体KOH中混有NaOH,由于NaOH的摩尔质量小于KOH,相同质量时,NaOH含有的n(OH-)大,则溶液中c(OH-)大于0.1mol/L。


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值。下列说法正确的是
A.密闭容器中,2 mol NO 和 1 mol O2 反应后分子总数为 2NA
B.标准状况下,7.8 g 乙炔和苯的混合物中含 C—H 键数目为 0.6NA
C.将 1 mol NH3 通入足量水中,NH3·H2O、NH4+粒子数目之和为 NA
D.1 L 0.1 mol·L1 FeCl3 溶液中含 Fe3+数目为 0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸亚铁可用于制备补血剂。某研究小组制备了 FeCO3,并对 FeCO3 的性质和应用进行了探究。
已知:①FeCO3 是白色固体,难溶于水②Fe2++6SCN-Fe(SCN)64-(无色)
Ⅰ.FeCO3 的制取(夹持装置略)
实验i
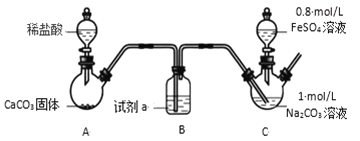
装置 C 中,向 Na2CO3 溶液(pH=11.9)通入一段时间 CO2 至其 pH 为 7,滴加一定量 FeSO4溶液,产生白色沉淀,过滤、洗涤、干燥,得到 FeCO3 固体。
(1)试剂 a 是________。
(2)向 Na2CO3 溶液通入 CO2 的目的是________。
(3)C 装置中制取 FeCO3 的离子方程式为________。
Ⅱ.FeCO3 的性质探究
实验ii
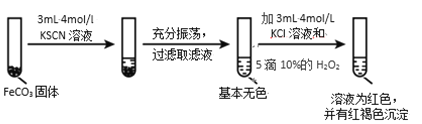
实验iii
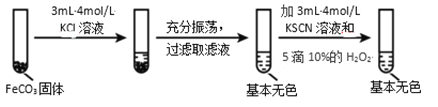
(4)对比实验ⅱ和ⅲ,得出的实验结论是________。
(5)依据实验ⅱ的现象,写出加入 10%H2O2 溶液的离子方程式________。
Ⅲ.FeCO3的应用
(6)FeCO3 溶于乳酸[CH3CH(OH)COOH]能制得可溶性乳酸亚铁补血剂,此反应的离子方程式为____。
(7)该实验小组用 KMnO4 测定补血剂中亚铁含量进而计算乳酸亚铁的质量分数,发现乳酸亚铁的质量分数总是大于 100%,其原因是____(不考虑操作不当引起的误差)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用黄铜矿(主要成分是CuFeS2)生产粗铜的反应原理如下:

(1)已知在反应①、②中均生成相同的气体分子,该气体具有漂白性。请分别写出反应①、②的化学方程式是___________________、__________________。
(2)基态铜原子的核外电子排布式为________,硫、氧元素相比,第一电离能较大的是________。
(3)反应①和②生成的气体分子的中心原子的杂化类型是________,分子的空间构型是________。
(4)某学生用硫酸铜溶液与氨水做了一组实验,CuSO4溶液中加氨水生成蓝色沉淀,再加氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体,请解释加入乙醇后析出晶体的原因_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组对人教版教材实验“在200mL烧杯中放入20g蔗糖(C12H22O11),加入适量水,搅拌均匀,然后再加入15mL质量分数为98%浓硫酸,迅速搅拌”进行如下探究;
(1)观察现象:蔗糖先变黄,再逐渐变黑,体积膨胀,形成疏松多孔的海绵状黑色物质,同时闻到刺激性气味,按压此黑色物质时,感觉较硬,放在水中呈漂浮状态,同学们由上述现象推测出下列结论:
①浓硫酸具有强氧化性 ②浓硫酸具有吸水性 ③浓硫酸具有脱水性④浓硫酸具有酸性 ⑤黑色物质具有强吸附性
其中依据不充分的是_________(填序号);
(2)为了验证蔗糖与浓硫酸反应生成的气态产物,同学们设计了如下装置:
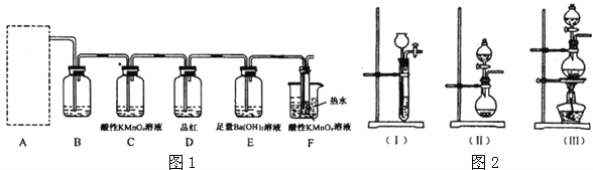
试回答下列问题:
①图1的A中最好选用下列装置_________(填编号);
②图1的 B装置所装试剂是_________;D装置中试剂的作用是_________;E装置中发生的现象是_________;
③图1的A装置中使蔗糖先变黑的化学反应方程式为_________,后体积膨胀的化学方程式为:_________;
④某学生按图2进行实验时,发现D瓶品红不褪色,E装置中有气体逸出,F装置中酸性高锰酸钾溶液颜色变浅,推测F装置中酸性高锰酸钾溶液颜色变浅的原因_________,其反应的离子方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
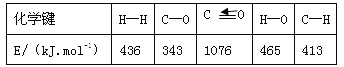
由此计算△H1= kJ·mol-1,已知△H2=-58kJ·mol-1,则△H3= kJ·mol-1。
(2)反应①的化学平衡常数K的表达式为 ;图1中能正确反映平衡常数K随温度变化关系的曲线为 (填曲线标记字母),其判断理由是 。
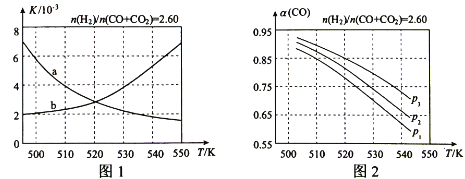
(3)合成气的组成n(H2)/n(CO+CO2)=2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。α(CO)值随温度升高而 (填“增大”或“减小”),其原因是 。图2中的压强由大到小为_____,其判断理由是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请选择适当的化学试剂和实验用品,用下图所示的装置(C中盛放的是过氧化钠)进行实验,证明过氧化钠可在呼吸面具和潜水艇中做供氧剂。
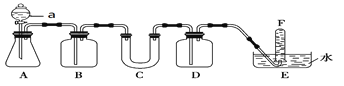
(1)A是实验室制取CO2的装置,写出A中发生反应的离子方程式________________。
(2)B中所加试剂是饱和NaHCO3溶液,它的作用是________________。
(3)写出C中发生反应的化学方程式__________________。
(4)F中得到的气体是__________,验证该气体的方法是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】120mL含有0.20mol碳酸钠的溶液和200mL盐酸,不管将前者滴入后者,还是将后者滴入前者,都有气体产生,但最终生成的气体体积不同,且比值为5:2,则盐酸的浓度是( )
A.2.0mol/LB.1.0mol/LC.0.18mol/LD.1.25mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从铜氨废液含[Cu(NH3)3·CO]+、[Cu(NH3)2]2+、[Cu(NH3)4]2+、NH3、CH3COO-、CO32-等中回收铜的工艺流程如图:

(1)步骤(Ⅰ)“吹脱”的目的是___(写一条即可);由步骤(Ⅱ)可确定NH3与H+的结合能力比与Cu2+的___(填“强”或“弱”)。
(2)步骤(Ⅲ)“沉铜”时,Na2S的用量比理论用量多,目的是___。
(3)步骤(Ⅳ)反应中,氧化产物与还原产物的物质的量之比为___。
(4)步骤(Ⅵ)发生反应生成难溶Cu2(OH)3Cl的离子方程式为___,pH与铜的回收率关系如图(a)所示,为尽可能提高铜的回收率,需控制的pH约为___。
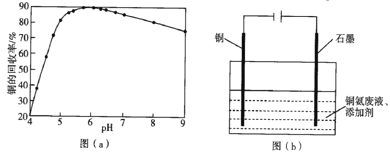
(5)“吹脱”后的铜氨溶液中加入适量的添加剂可直接电解回收金属铜,装置如图(b)所示,阴极主要发生的电极方程式为___;添加NaCl和H2SO4均可提高电导率和电流效率,从而提高铜的回收率,从环境角度考虑,较好的是___(填“NaCl”或“H2SO4”)。
(6)已知上述流程中只有步骤(Ⅲ)“沉铜”和步骤Ⅴ“制硫酸铜”中铜元素有损耗。步骤(Ⅲ)“沉铜”时铜元素的损耗率为4%;步骤Ⅴ“制硫酸铜”时铜元素损耗率为2%。若1L废液最终制得CuSO45H2O375g,则1L废液中含有铜元素的质量为___g。(保留整数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com