
【题目】120mL含有0.20mol碳酸钠的溶液和200mL盐酸,不管将前者滴入后者,还是将后者滴入前者,都有气体产生,但最终生成的气体体积不同,且比值为5:2,则盐酸的浓度是( )
A.2.0mol/LB.1.0mol/LC.0.18mol/LD.1.25mol/L
【答案】D
【解析】
当碳酸钠滴入盐酸中时发生CO32-+2H+═H2O+CO2↑,
当盐酸滴入碳酸钠溶液时,反应顺序为CO32-+H+═HCO3-、HCO3-+H+═H2O+CO2↑,都有气体产生,说明HCl的物质的量应大于Na2CO3的物质的量,又因为最终生成的气体体积不同,当碳酸钠滴入盐酸中时碳酸钠有剩余,当盐酸滴入碳酸钠溶液时,第一步反应完全,第二步反应碳酸氢根离子有剩余。
设HCl为nmol;当碳酸钠滴入盐酸中时发生CO32-+2H+═H2O+CO2↑反应,生成CO2的物质的量为![]() mol;当盐酸滴入碳酸钠溶液时,反应顺序为CO32-+H+═HCO3-、HCO3-+H+═H2O+CO2↑,发生CO32-+H+═HCO3-反应消耗盐酸0.2mol,发生HCO3-+H+═H2O+CO2↑反应,消耗盐酸(n-0.2)mol,所以生成CO2的物质的量为(n-0.2)mol,则
mol;当盐酸滴入碳酸钠溶液时,反应顺序为CO32-+H+═HCO3-、HCO3-+H+═H2O+CO2↑,发生CO32-+H+═HCO3-反应消耗盐酸0.2mol,发生HCO3-+H+═H2O+CO2↑反应,消耗盐酸(n-0.2)mol,所以生成CO2的物质的量为(n-0.2)mol,则![]() :(n-0.2)=5:2,n=0.25,盐酸的浓度是
:(n-0.2)=5:2,n=0.25,盐酸的浓度是![]() 1.25mol/L,故选D。
1.25mol/L,故选D。


科目:高中化学 来源: 题型:
【题目】铁(Fe)、铜(Cu)、银(Ag)是常见的金属元素,它们的单质及其化合物在生活中有广泛应用。
(1)Ag 与 Cu 在同一族,则 Ag 在周期表中________ (填“s”、“p”、“d”或“ds”)区;[Ag(NH3)2]+中 Ag+空的 5s 轨道和 5p 轨道以sp 杂化成键,则该配离子的空间构型是________。
(2)基态 Cu+的简化电子排布式为________。
(3)表中是 Fe 和 Cu 的部分电离能数据:请解释 I2(Cu)大于 I2(Fe)的主要原因:________。
元素 | Fe | Cu |
第一电离能 I1/kJ·mol-1 | 759 | 746 |
第二电离能 I2/kJ·mol-1 | 1561 | 1958 |
(4)亚铁氰化钾是食盐中常用的抗结剂,其化学式为 K4[Fe(CN)6]。
①CN-的电子式是________;1mol 该配离子中含σ 键数目为________。
②该配合物中存在的作用力类型有________ (填字母)。
A.金属键 B.离子键 C.共价键 D.配位键 E.氢键 F.范德华力
(5)氧化亚铁晶体的晶胞结构如图所示。已知:
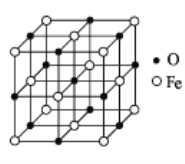
氧化亚铁晶体的密度为 ρgcm﹣3,NA代表阿伏加德罗常数的值。在该晶胞中,与 Fe2+紧邻且等距离的 Fe2+数目为________,Fe2+与O2﹣最短核间距为________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用固体KOH配制0.1mol/L 的KOH溶液 480mL,回答下列问题:
(1)配制过程中需要用到的玻璃仪器有烧杯,玻璃棒,量筒,胶头滴管,____________。
(2)需要用托盘天平称量_______gKOH固体。
(3)如果在定容时仰视操作,则所配得溶液的浓度_____0.1mol/L(填> , = , <)容量瓶不干燥,有一定的水分,则所配得溶液的浓度_____0.1mol/L(填> , = , <)
(4)若所用的固体KOH中混有NaOH,则所配得溶液的c(OH-)浓度______0.1mol/L (填> , = , <)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铝土矿和黄铁矿的共生矿(主要成分为Al2O3、FeS2和SiO2),由此矿石制备Fe3O4和Al2O3的流程如下图所示,回答下列问题:
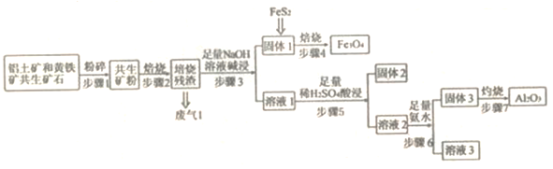
(1)“步骤2”焙烧过程产生的废气为 _________。
(2)已知“步骤4”隔绝空气焙烧,则化学方程式为________(已知该过程产生的废气和废气1成分相同)。
(3)“固体2”的成分是_________,步骤5的分离方法是_________。
(4)写出步骤5的离子方程式__________。
(5)若原矿石质量为bkg,经过该过程获得的Fe3O4的质童为akg,则原矿石中铁元素的质量分数为________。
(6)该流程中存在较为明显的缺陷是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 醋酸溶解水垢中的CaCO3: CaCO3 + 2H+= Ca2++ H2O + CO2↑
B. 惰性电极电解饱和MgCl2溶液: Mg2++2Cl- + 2H2O ![]() Mg(OH)2↓ + H2↑ + Cl2↑
Mg(OH)2↓ + H2↑ + Cl2↑
C. 苯酚钠溶液中通入少量的CO2:![]() +H2O+CO2→
+H2O+CO2→ +
+![]()
D. 用银氨溶液检验乙醛中的醛基:CH3CHO+![]() +2OH-
+2OH-![]() CH3COONH4+H2O+2Ag↓+3NH3↑
CH3COONH4+H2O+2Ag↓+3NH3↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)还原铁粉与高温水蒸气反应的化学方程式:_____________________________________;
(2)除去Mg粉中的Al粉的试剂是__________ ,反应的离子方程式为:____________;
(3)高铁酸钠(Na2FeO4)具有强氧化性,可对自来水进行消毒、净化。高铁酸钠可用氢氧化铁和次氯酸钠在碱性介质中反应得到,请补充并配平下面离子方程式。
____Fe(OH)3 +____ClO-+____OH- =__FeO42-+___Cl-+__(_______)
(4)在反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,氧化剂是________________;还原剂是_______________;当有11molP参加反应,转移的电子的物质的量为________;1molCuSO4能氧化的P原子的数目为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对氧化还原反应的分析中合理的是
A.Mg变为MgO时化合价升高,因此,Mg在该反应中作还原剂
B.KMnO4受热分解时,Mn元素化合价一方面升高一方面降低,因此,在该反应中Mn元 素既被氧化又被还原
C.凡是氧化还原反应都能造福人类
D.在反应2H2O![]() 2H2↑+ O2↑中H2O是还原剂
2H2↑+ O2↑中H2O是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子化合物G( )是一种重要的合成聚酯纤维,其合成路线如下:
)是一种重要的合成聚酯纤维,其合成路线如下:

已知:
① +
+ +R2OH
+R2OH
② +R3OH
+R3OH![]()
 +R2OH
+R2OH
(1)F的结构简式为_______________,①的反应类型为______________,E中官能团名称为______________,⑤的反应方程式为______________。
(2)写出符合下列条件E的同分异构体______________(填结构简式,不考虑立体异构)。
①含有苯环,遇![]() 溶液不变色
溶液不变色
②能发生银镜反应
③核磁共振氢光谱图峰面积之比为1:3:6:6
(3)判断化合物E中有无手性碳原子,若有,用“*”标出_________。
(4)写出以1,3-丙二醇和甲醇为原料制备 的合成路线(其它试剂任选)___________
的合成路线(其它试剂任选)___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家在利用无土栽培法培养一些名贵花卉时,培养液中添加了多种必需化学元素。其配方如下:
离子 |
|
|
|
|
|
|
|
|
培养液浓度 | 1 | 1 | 0.25 | 1 | 2 | 1 | 0.25 | 1 |
其中花卉根细胞吸收最少的离子是( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com