
【题目】碳酸亚铁可用于制备补血剂。某研究小组制备了 FeCO3,并对 FeCO3 的性质和应用进行了探究。
已知:①FeCO3 是白色固体,难溶于水②Fe2++6SCN-Fe(SCN)64-(无色)
Ⅰ.FeCO3 的制取(夹持装置略)
实验i
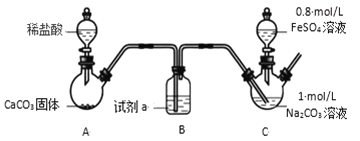
装置 C 中,向 Na2CO3 溶液(pH=11.9)通入一段时间 CO2 至其 pH 为 7,滴加一定量 FeSO4溶液,产生白色沉淀,过滤、洗涤、干燥,得到 FeCO3 固体。
(1)试剂 a 是________。
(2)向 Na2CO3 溶液通入 CO2 的目的是________。
(3)C 装置中制取 FeCO3 的离子方程式为________。
Ⅱ.FeCO3 的性质探究
实验ii
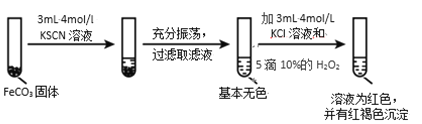
实验iii
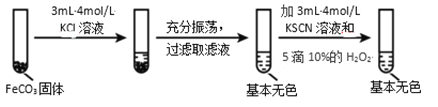
(4)对比实验ⅱ和ⅲ,得出的实验结论是________。
(5)依据实验ⅱ的现象,写出加入 10%H2O2 溶液的离子方程式________。
Ⅲ.FeCO3的应用
(6)FeCO3 溶于乳酸[CH3CH(OH)COOH]能制得可溶性乳酸亚铁补血剂,此反应的离子方程式为____。
(7)该实验小组用 KMnO4 测定补血剂中亚铁含量进而计算乳酸亚铁的质量分数,发现乳酸亚铁的质量分数总是大于 100%,其原因是____(不考虑操作不当引起的误差)。
【答案】饱和 NaHCO3 溶液 降低溶液中OH-浓度,防止生成 Fe(OH)2 2HCO3-+Fe2+=FeCO3↓+CO2↑+H2O Fe2+与 SCN—的络合(或结合)会促进 FeCO3 固体的溶解 6Fe(SCN)64- +3H2O2=2Fe(OH)3↓ +4Fe(SCN)3 +24SCN- FeCO3+2CH3CH(OH)COOH=2CH3CH(OH)COO- +Fe2++CO2↑+H2O 乳酸根中的羟基被 KMnO4 氧化,也消耗了 KMnO4
【解析】
Ⅰ.装置A中碳酸钙和稀盐酸反应生成的CO2中混有挥发的HCl气体,需要利用装置B中盛装的饱和NaHCO3溶液除去,装置C中,向Na2CO3溶液(pH=11.9)通入一段时间CO2至其pH为7,滴加一定量FeSO4溶液,产生白色沉淀,过滤、洗涤、干燥,得到FeCO3固体;
Ⅱ.(4)根据Fe2++6SCN-![]() Fe(SCN)64-分析FeCO3在KCl和KSCN两种不同溶液中的溶解度不同判断;
Fe(SCN)64-分析FeCO3在KCl和KSCN两种不同溶液中的溶解度不同判断;
(5)实验ⅱ中溶液显红色且有红褐色沉淀生成,说明加入10%H2O2溶液后有Fe(OH)3和Fe(SCN)3生成;
Ⅲ.(6)FeCO3溶于乳酸[CH3CH(OH)COOH]能制得可溶性乳酸亚铁补血剂,可结合盐和酸反应生成新酸和新盐的反应原理分析;
(7)乳酸根中羟基也能被高锰酸钾溶液氧化。
Ⅰ.(1)欲除去CO2中混有的HCl,则B中盛装的试剂a是饱和NaHCO3溶液,故答案为:饱和 NaHCO3溶液;
(2)向Na2CO3溶液通入CO2的目的是,利用碳酸钠和CO2反应生成的NaHCO3,提高溶液中HCO3-的浓度,抑制CO32-的水解,降低溶液中OH-浓度,防止生成Fe(OH)2,故答案为:降低溶液中OH-浓度,防止生成 Fe(OH)2;
(3)装置C中,向Na2CO3溶液(pH=11.9)通入一段时间CO2至其pH为7,此时溶液中溶质主要为NaHCO3,再滴加FeSO4溶液,有FeCO3沉淀生成,发生反应的离子方程式为2HCO3-+Fe2+=FeCO3+CO2↑+H2O,故答案为:2HCO3-+Fe2+=FeCO3↓+CO2↑+H2O;
Ⅱ. (4)通过对比实验ⅱ和ⅲ,可知Fe2+与SCN—的络合生成可溶于水的Fe(SCN)64-,会促进FeCO3固体的溶解,故答案为:Fe2+与 SCN—的络合(或结合)会促进 FeCO3 固体的溶解;
(5)依据实验ⅱ的现象,可知在含有Fe(SCN)64-的溶液中滴加10%H2O2溶液后有Fe(OH)3和Fe(SCN)3生成,发生反应的离子方程式为6Fe(SCN)64- +3H2O2=2Fe(OH)3↓ +4Fe(SCN)3 +24SCN,故答案为:6Fe(SCN)64- +3H2O2=2Fe(OH)3↓ +4Fe(SCN)3 +24SCN-;
Ⅲ. (6)FeCO3溶于乳酸制得可溶性乳酸亚铁补血剂,发生反应的离子方程式为FeCO3+2CH3CH(OH)COOH=2CH3CH(OH)COO-+Fe2++CO2↑+H2O,故答案为:FeCO3+2CH3CH(OH)COOH=2CH3CH(OH)COO-+Fe2++CO2↑+H2O;
(7)乳酸根中含有羟基,可以被酸性高锰酸钾溶液氧化,导致消耗高锰酸钾的增大,而计算中按亚铁离子被氧化,故计算所得乳酸亚铁的质量偏大,产品中乳酸亚铁的质量分数会大于100%,故答案为:乳酸根中的羟基被KMnO4 氧化,也消耗了KMnO4。


科目:高中化学 来源: 题型:
【题目】实验室利用反应![]() 合成洋茉莉醛的流程如下。下列说法错误的是
合成洋茉莉醛的流程如下。下列说法错误的是
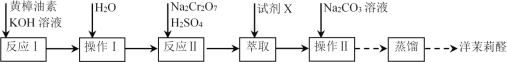
A.水洗的目的是除去KOHB.试剂X应选用有机溶剂
C.加入Na2CO3溶液的目的是除去酸D.进行蒸馏操作时可选用球形冷凝管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素X、Y、Z质子数都小于18,并且质子数X+Y=Z。X原子的电子层数与核外电子总数相同,Z原子有两个电子层,最外层电子数是内层电子数的三倍,则:
(1)写出元素符号:X_______, Y _________ ; Z的离子结构示意图为__________。
(2)由Y、Z组成,且质量比为7:20的化合物化学式为____________ 。
(3)X、Z可以形成两种常见化合物A和B,A中X、Z原子个数比为2 : 1,则A的摩尔质量为_____,实验室常用B制少量的氧气,写出化学反应方程式_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁(Fe)、铜(Cu)、银(Ag)是常见的金属元素,它们的单质及其化合物在生活中有广泛应用。
(1)Ag 与 Cu 在同一族,则 Ag 在周期表中________ (填“s”、“p”、“d”或“ds”)区;[Ag(NH3)2]+中 Ag+空的 5s 轨道和 5p 轨道以sp 杂化成键,则该配离子的空间构型是________。
(2)基态 Cu+的简化电子排布式为________。
(3)表中是 Fe 和 Cu 的部分电离能数据:请解释 I2(Cu)大于 I2(Fe)的主要原因:________。
元素 | Fe | Cu |
第一电离能 I1/kJ·mol-1 | 759 | 746 |
第二电离能 I2/kJ·mol-1 | 1561 | 1958 |
(4)亚铁氰化钾是食盐中常用的抗结剂,其化学式为 K4[Fe(CN)6]。
①CN-的电子式是________;1mol 该配离子中含σ 键数目为________。
②该配合物中存在的作用力类型有________ (填字母)。
A.金属键 B.离子键 C.共价键 D.配位键 E.氢键 F.范德华力
(5)氧化亚铁晶体的晶胞结构如图所示。已知:
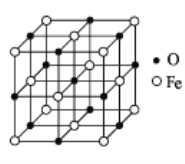
氧化亚铁晶体的密度为 ρgcm﹣3,NA代表阿伏加德罗常数的值。在该晶胞中,与 Fe2+紧邻且等距离的 Fe2+数目为________,Fe2+与O2﹣最短核间距为________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料,在生活和生产中的应用十分广泛。
请回答:
(1)在工业上,“氯碱工业”是生产氯气的主要方法。请写出工业制备氯气的离子方程式__________________________。
(2)实验室常用MnO2 与浓盐酸反应制备Cl2,装置如图1所示:
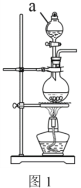
仪器a的名称为______。制备实验开始时,先检査装置气密性,接下来的操作依次是:___________(填序号)。
①往烧瓶中加入MnO2粉末 ②加热 ③往烧瓶中加入浓盐酸
(3)为证明Cl2与H2O反应为可逆反应,将生成的气体通入图2所示装置:

①装置A中应加入的试剂是____________。
②证明可逆反应,需验证在B中反应物和生成物同时存在,证明氯水中有Cl2存在的现象是______,仅使用一种试剂证明氯水中HCl和HClO均存在,合适的试剂是_____。
A.AgNO3溶液 B.石蕊试液
C.NaOH溶液 D.品红溶液
③装置C中NaOH溶液的作用是___________________。
(4)制备反应会因盐酸浓度下降而停止,为测定反应残余液中盐酸的浓度(残余液体积已知)。甲同学提出下列具体方案。请你从下列实验方案中选择合理的实验方法______。
A.在残余液中加入足量AgNO3溶液,过滤,洗涤,干燥,称量沉淀的质量
B.在残余液中加入足量NaHCO3固体,将反应后的气体直接用碱石灰吸收,测定生成的气体的质量
C.在残余液中加入足量锌片,测量生成气体的体积,折算成标准状况下的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)SO2和SO3是硫的两种氧化物,等温等压下,等质量的SO2和SO3所含分子个数比为________,氧原子个数比为________,等温等压下气体体积比_____________。
(2)100mL的某气体的质量为0.143g,该气体的相对分子质量:______________,
(3)设NA为阿伏加德罗常数的数值,如果ag某气体中含有的分子数为b,则cg该气体在标准状况下的体积约是___________L(用含NA的式子表示)。
(4)配制100 mL1 mol/L的H2SO4溶液,需要用量筒量取浓H2SO4(密度为1.84g·mL-1,质量分数为98%)的体积为__________mL。
(5)10.6gNa2CO3溶于水,配成500mL的溶液,溶液中溶质的物质的量________,Na+的物质的量浓度______________。
(6)标准状况下,5.6LNH3中氢原子的数目为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用固体KOH配制0.1mol/L 的KOH溶液 480mL,回答下列问题:
(1)配制过程中需要用到的玻璃仪器有烧杯,玻璃棒,量筒,胶头滴管,____________。
(2)需要用托盘天平称量_______gKOH固体。
(3)如果在定容时仰视操作,则所配得溶液的浓度_____0.1mol/L(填> , = , <)容量瓶不干燥,有一定的水分,则所配得溶液的浓度_____0.1mol/L(填> , = , <)
(4)若所用的固体KOH中混有NaOH,则所配得溶液的c(OH-)浓度______0.1mol/L (填> , = , <)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对氧化还原反应的分析中合理的是
A.Mg变为MgO时化合价升高,因此,Mg在该反应中作还原剂
B.KMnO4受热分解时,Mn元素化合价一方面升高一方面降低,因此,在该反应中Mn元 素既被氧化又被还原
C.凡是氧化还原反应都能造福人类
D.在反应2H2O![]() 2H2↑+ O2↑中H2O是还原剂
2H2↑+ O2↑中H2O是还原剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com